
§6-1热力学第零定律和第一定律 一、热力学第零定律 如果物体A和处于确定状态的物体B热接触而 处于热平衡,另有物体C和此物体B也热接触而处于 热平衡,那么,物体A和物体C热接触就必定也处于 热平衡。这个结论称为热力学第零定律。 二、热力学过程 热力学系统从一个平衡态过渡到另一个平衡 态所经过的变化历程就称为热力学过程。 准静态过程:在过程中每一时刻,系统都处于平 衡态,这是一种理想过程。 上美不家返可退此
上页 下页 返回 退出 一、热力学第零定律 如果物体A和处于确定状态的物体B 热接触而 处于热平衡,另有物体C和此物体B也热接触而处于 热平衡,那么,物体A和物体C热接触就必定也处于 热平衡。这个结论称为热力学第零定律。 二、 热力学过程 热力学系统从一个平衡态过渡到另一个平衡 态所经过的变化历程就称为热力学过程。 准静态过程:在过程中每一时刻,系统都处于平 衡态,这是一种理想过程。 §6-1 热力学第零定律和第一定律
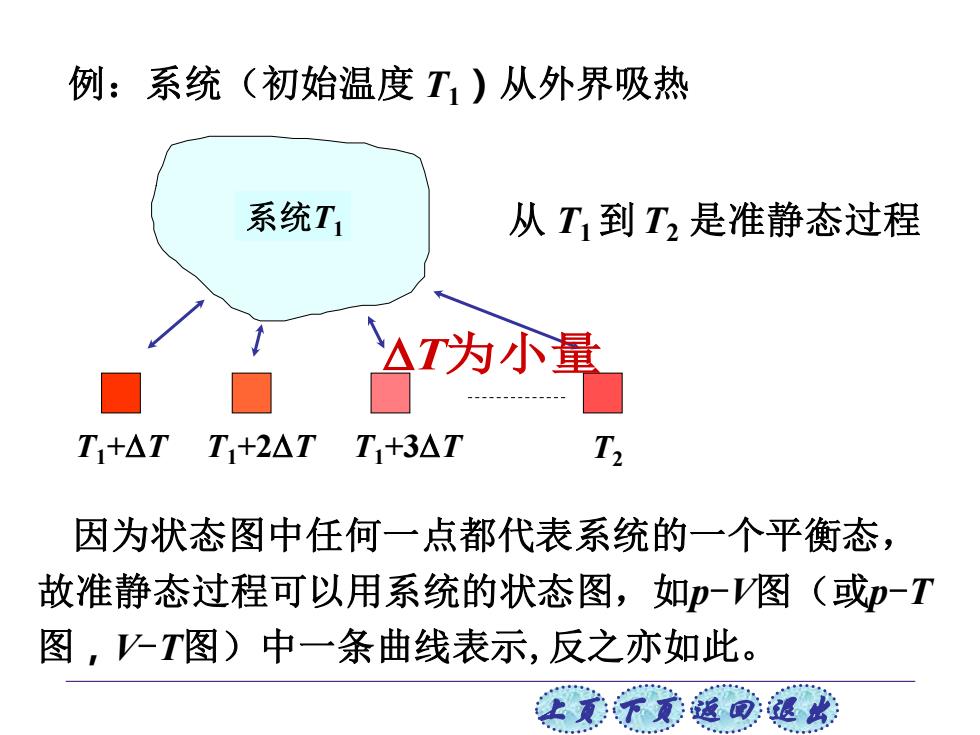
例:系统(初始温度T1)从外界吸热 系统T1 从T到T,是准静态过程 △T内小量 T+△T T1+2△TT1+3△T T 因为状态图中任何一点都代表系统的一个平衡态, 故准静态过程可以用系统的状态图,如p一V图(或p-T 图,-T图)中一条曲线表示,反之亦如此。 让美觉返司退
上页 下页 返回 退出 例:系统(初始温度 T1)从外界吸热 从 T1 到 T2 是准静态过程 因为状态图中任何一点都代表系统的一个平衡态, 故准静态过程可以用系统的状态图,如p-V图(或p-T 图,V-T图)中一条曲线表示,反之亦如此。 系统T1 T1+T T1+2T T1+3T T2 T为小量
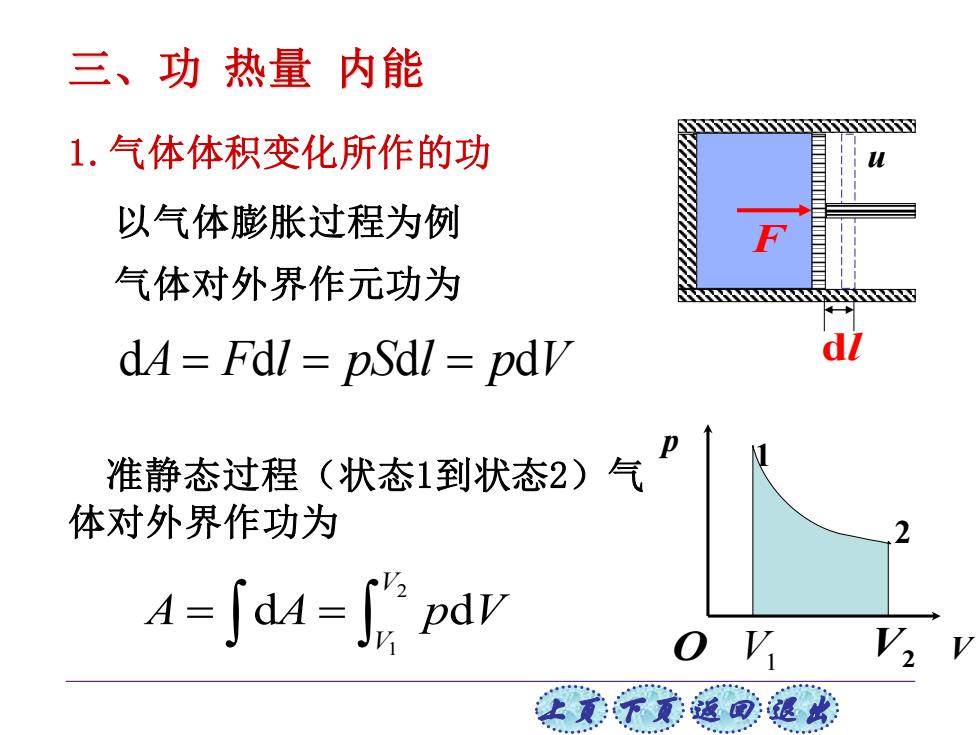
三、功热量内能 1.气体体积变化所作的功 以气体膨胀过程为例 气体对外界作元功为 dA=Fdl pSdl pdv 准静态过程(状态1到状态2)气 体对外界作功为 2 A=∫dM=6pdw o V 上美子意蕴可退
上页 下页 返回 退出 准静态过程(状态1到状态2)气 体对外界作功为 d d d d A F l pS l p V = = = 1.气体体积变化所作的功 2 1 d d V V A A p V = = u F dl 气体对外界作元功为 以气体膨胀过程为例 三、功 热量 内能 V p 1 2 O V1 V2

A=∫dA=JGpw dV>0,dA>0,系统对外作正功; dV<0,dA<0,系统对外作负功; dV=0,d4=0,系统不作功。 1-f"par 由积分意义可知,功的大小等于V图上过程曲 线()下的面积。功的数值不仅与初态和末态有关, 而且还依赖于所经历的中间状态,功与过程的路 径有关。 让美下觉返同速
上页 下页 返回 退出 d 0, d 0, V A 系统对外作正功; d 0, d 0, V A 系统对外作负功; d 0, d 0, V A = = 系统不作功。 2 1 d d V V A A p V = = 由积分意义可知,功的大小等于p-V 图上过程曲 线p(V)下的面积。功的数值不仅与初态和末态有关, 而且还依赖于所经历的中间状态,功与过程的路 径有关。 2 1 d V V A p V =

2.气体的内能 理想气体内能: E- LRT 内能是状态量,是状态参量T的单值函数。 实际气体内能: 所有分子热运动的动能和分子间势能的总和。 内能是状态参量T、的单值函数。 让意了京适可:退此
上页 下页 返回 退出 2.气体的内能 实际气体内能: 所有分子热运动的动能和分子间势能的总和。 理想气体内能: mol 2 m i E RT M = 内能是状态量,是状态参量T的单值函数。 内能是状态参量T、V的单值函数