
618 我反应第14章 表1+一3羧酸衍生物用催化氢化法还原的产物 00 RCOCR RCOR RCNH:(R) 反应物 c 0 R-CN (CH2 NH(R) 还原 1一般情况 1.一觳情况 1.一般情况 1.一般情况 RCH:NH: 产物 RCH2OH+R'CH:OH RCH2OH+R'OH RCH:NHz(R .Rosenmund法2.环状酸酐 2.内酯 内酰胺 HOCH:(CHa).CH.OH HO(CH2).CH.OH (CHD.NH(R) CuO-CuCrO 这个反应大量应用于催化氢解植物油和脂肪(fat),以取得长链醇类,如硬脂醇(stearyl alcohol)、 软脂醇(palmitic alcohol)等混合物,不饱和脂肪酸酯的双键同时被饱和,它们可以用来做洗涤剂 (detergent)(去污剂),化学试剂等。苯基在催化氢解过程中保持不变: 125℃,30MPa 65% 酰胺很不易还原,用催化氢化法还原,需用特殊的催化剂并在高温高压下进行: CuCr氧化物 人NH,0m22入入入入入人NH 正十二碳胺 腈可用催化氢化法还原成一级胺。 液氢,l3MPa 87% 14.5.2用金属氢化物还原 常用的金属氢化物(metal hydride)有氢化铝锂、硼氢化锂和硼氢化钠。硼氢化锂可由氢 化钠与氯化锂在乙醇中制备。 NaBH.+LKI COH LiBH,+NaCI
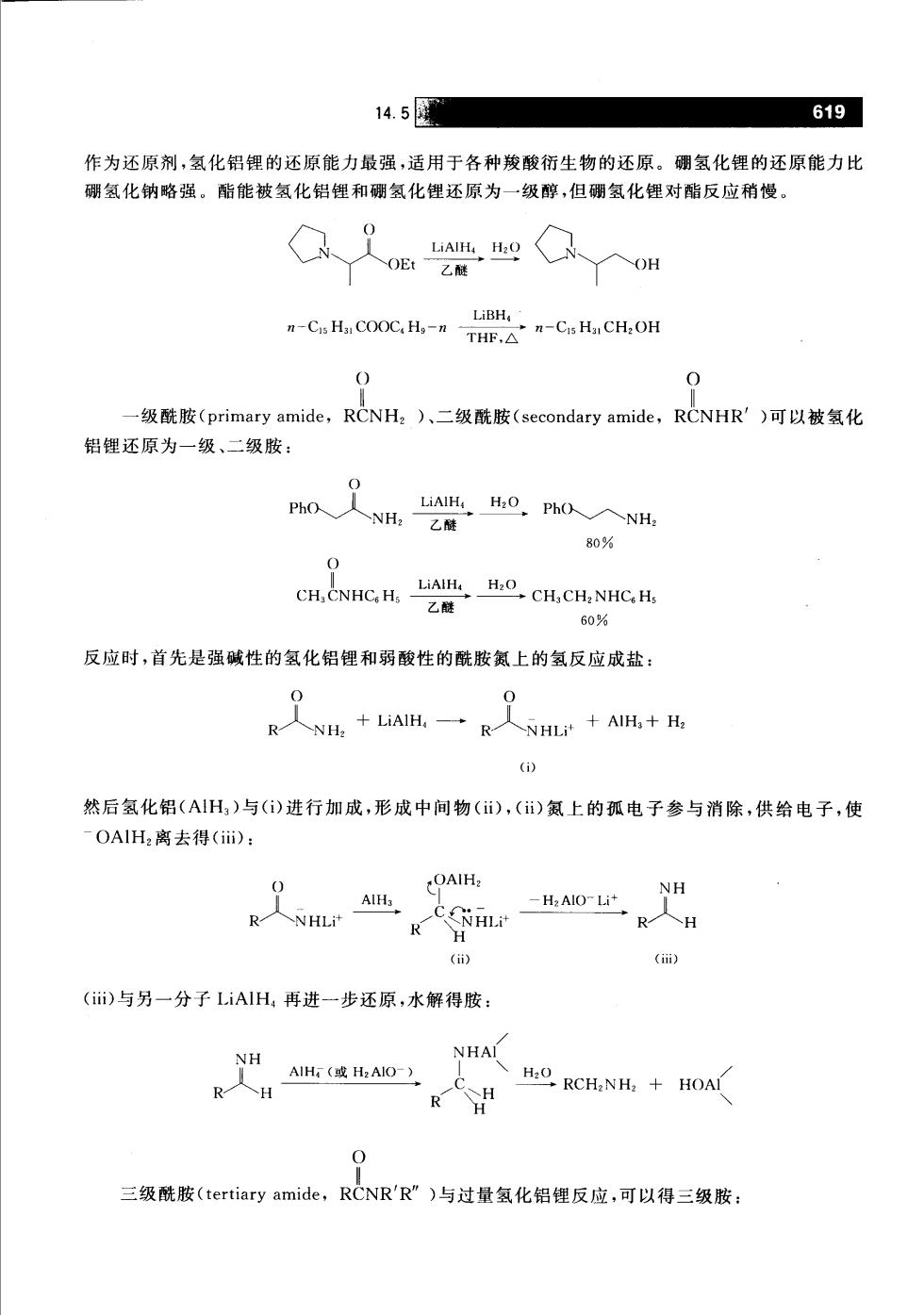
14.5 619 作为还原剂,氢化铝锂的还原能力最强,适用于各种羧酸衍生物的还原。硼氢化锂的还原能力比 硼氢化钠略强。酯能被氢化铝锂和硼氢化锂还原为一级醇,但硼氢化锂对酯反应稍慢。 OH LiBH, -C.H COOC,H.-C H CH.OH 0 一级酰胺(primary amide,RCNH:)、二级酰胺(secondary amide,RCNHR')可以被氢化 铝锂还原为一级、二级胺: 80% 反应时,首先是强碱性的氢化铝锂和弱酸性的酰胺氮上的氢反应成盐: 0 人NH,+,一R人NH+ANH+ (i) 然后氢化铝(AIH)与()进行加成,形成中间物(i),(i)氮上的孤电子参与消除,供给电子,使 OA1H2离去得(ii): OAIH: -H2 AlO-Li R人NHLP R H () (i) (ii)与另一分子LiAlH再进一步还原,水解得胺: NH NHAI R人H ANH(或H:AIO) H2O RCHNH,+HOA 0 三级酰胺(tertiary amide,RCNR'R”)与过量氢化铝锂反应,可以得三级胺:

620 ?酸行生物酰基碳上的亲核取代反应第14章 ○C-Me, 乙 C Me一CH-NMe〈CH:NMe 88% (iv) (v) 三级酰胺的羰基先与第一个氢负离子(hydrogen anion)进行加成反应,得四面体中间体(iv), (iv)失去OAIH2得亚铵盐(v),(v)再接受第二个氢负离子的进攻,得三级胺。 如果反应时小心控制氢化铝锂不过量,则第二个氢负离子进行亲核反应的机会很少,亚铵盐 进行水解,可以得到醛,例如: OAIH 乙避,0C 一 Me Me 入入PhH0. CHO+PhNHMe Me 58% 一般米说,直接用氢化铝锂还原,所得醛产率不高,现在对羧酸衍生物还原为醛进行了广泛的研 究,在前面已经讨论过(参见12.15/1(1))在氢化铝锂中引入烷氧基后改变了试剂的还原能力, 这种试剂能比较成功地把三级酰胺还原为醛,例如三乙氧氢化铝锂[LiA1H(CHO):]、二乙氧 氢化铝锂[LiA1H:(C:HO),]等均是比较好的试剂,由于这些试剂的空间位阻较大,同时三级酰 胺氮上有取代基,空间位阻也较大,第一分子试剂与三级酰胺加成后,第二个氢负离子不易进入, 因此,醛的产量很好。例如: OLiAl(OED LiAIH(OE) HO.入CH0+MeNH 乙酰 90% CHO NMe LiAIH:(OED):HO 乙醚 90% 腈用LiAlH还原得一级胺。例如: .CH.NH. 85% 14.5.3酯用金属钠还原 1.Bouveault-Blanc还原
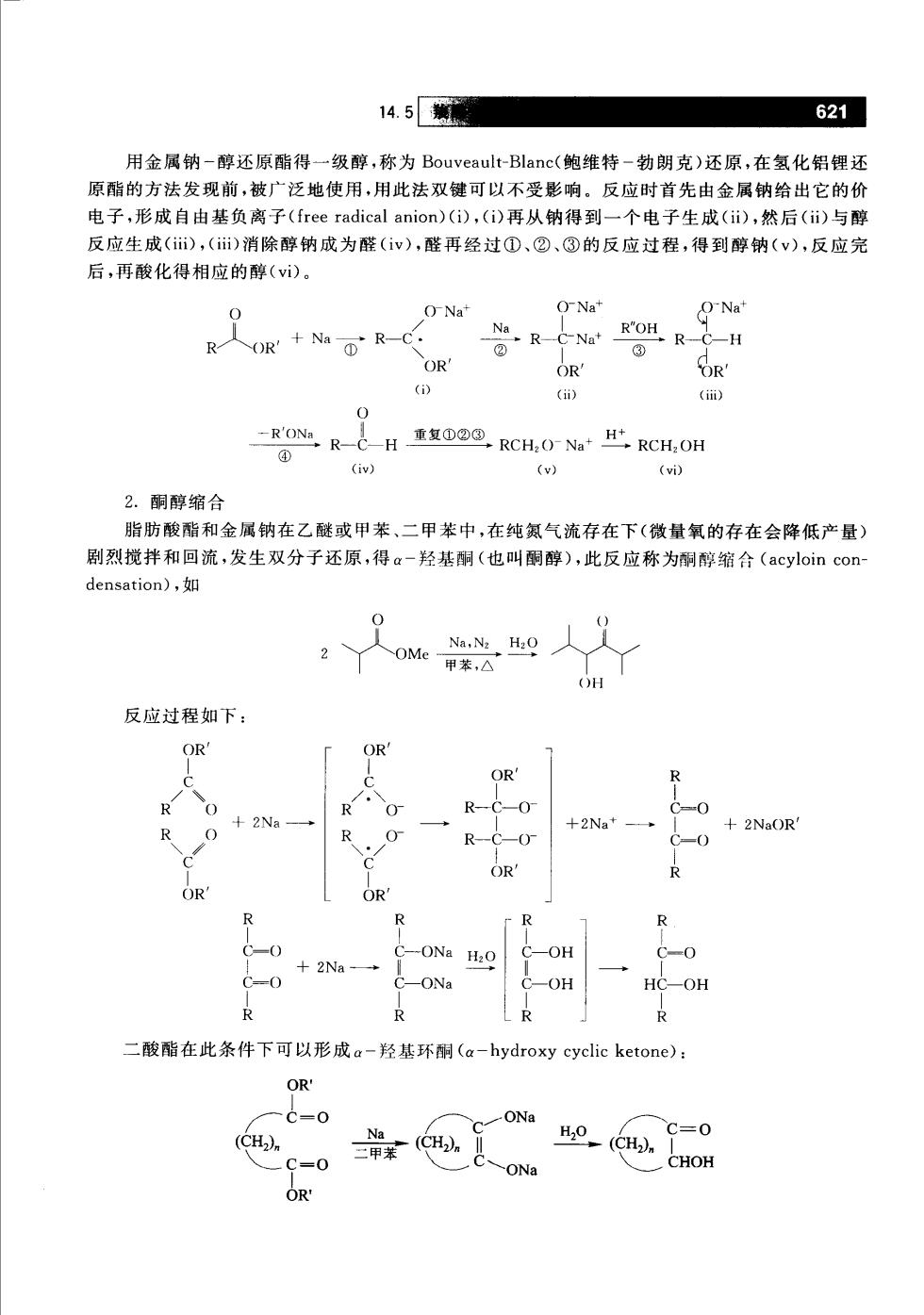
14.5 621 用金属钠-醇还原酯得一级醇,称为Bouveault-Blanc((鲍维特-勃朗克)还原,在氢化铝锂还 原酯的方法发现前,被广泛地使用,用此法双键可以不受影响。反应时首先由金属钠给出它的价 电子,形成自由基负离子(free radical anion)(i),(i)再从钠得到一个电子生成(i),然后(i)与醇 反应生成(),()消除醇钠成为醛(v),醛再经过①、②、③的反应过程,得到醇钠(v),反应完 后,再酸化得相应的醇(i)。 ONa O-Na+ ONa' R人OR+DR-C OR' OR' OR' () 0 -RO心R-CH重复RCH,ONa比RCH,OH ④ (iv) (w) (vi) 2.酮醇缩合 脂肪酸酯和金属钠在乙醚或甲苯、二甲苯中,在纯氮气流存在下(微量氧的存在会降低产量) 剧烈搅拌和回流,发生双分子还原,得a-羟基酮(也叫酮醇),此反应称为酮醇缩合(acyloin con- densation),如 2 OH 反应过程如下: OR' OR OR +2Na* 2NaOR R OR' OR R R -ONa H2O C-OH C-0 -2Na C-0 C-ONa C-OH HC-OH R R R 二酸酯在此条件下可以形成a-羟基环酮(a-hydroxy cyclic ketone): OR. C=0 ONa C=0 (CH2). Ho (CH2), -0 -ONa CHOH
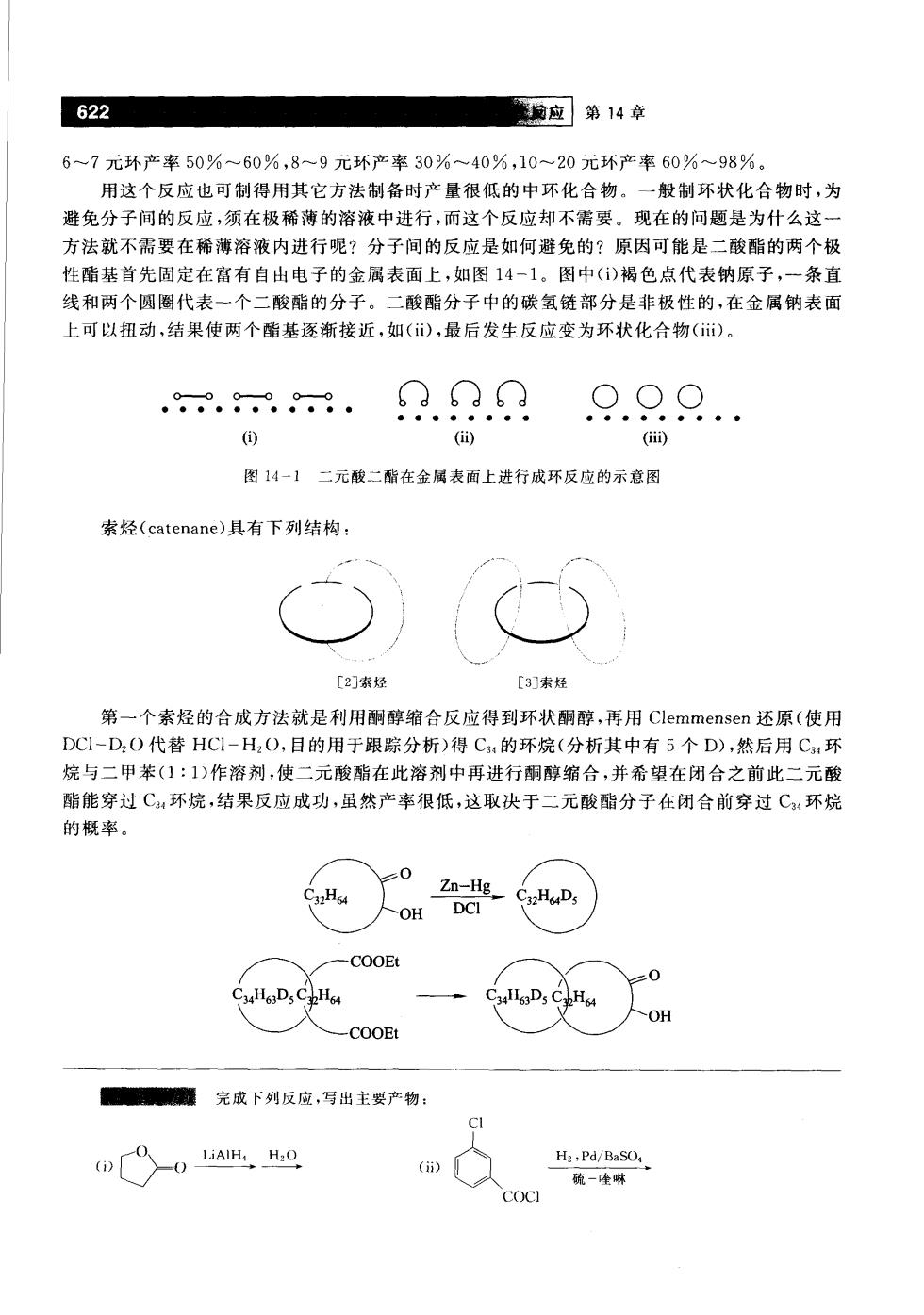
622 输应第14章 6~7元环产率50%~60%,8~9元环产率30%~40%,10一20元环产率60%~98% 用这个反应也可制得用其它方法制备时产量很低的中环化合物。一般制环状化合物时,为 避免分子间的反应,须在极稀薄的溶液中进行,而这个反应却不需要。现在的问题是为什么这一 方法就不需要在稀薄溶液内进行呢?分子间的反应是如何避免的?原因可能是二酸酯的两个极 性酯基首先固定在富有自由电子的金属表面上,如图14-1。图中()褐色点代表钠原子,一条直 线和两个圆圈代表一个二酸酯的分子。二酸酯分子中的碳氢链部分是非极性的,在金属钠表面 上可以扭动,结果使两个酯基逐渐接近,如(),最后发生反应变为环状化合物()。 .-.9.90. ( (in) 图14-】二元酸二酯在金属表面上进行成环反应的示意图 索烃(catenane)具有下列结构: [2索经 [3]索烃 第一个索烃的合成方法就是利用酮醇缩合反应得到环状酮醇,再用Clemmensen还原(使用 DCI-D,O代替HC1-H:O,目的用于跟踪分析)得C:的环烷(分析其中有5个D),然后用C,环 烷与二甲苯(1:1)作溶剂,使二元酸酯在此溶剂中再进行酮醇缩合,并希望在闭合之前此二元酸 酯能穿过C环烷,结果反应成功,虽然产率很低,这取决于二元酸酯分子在闭合前穿过C,环烷 的概率 0 .Ha OH -COOE 0 C.HoD. CHD,CpH。 OH COOE 完成下列反应,号出主要产物: