
有关水合质子的结构数据 水合质子 结 构 0(0 距离(A) 化.合 物 说 明 [H,OJX(X=F, 与NH,分子构 Cl,Br,I) 型相同,为三角 H;O+ [H,O]CIO, 锥形 [H,O]HSO, [H;O]SO. [H,O-H-OH,]+ 2.424 [H,O]Cio, H为中心对称 H,O [11:O-i.O1,]t 2.47 [H,O,]AuCl 不对称 ·2H0 0-H=0.99X H.0=1.43A T1H,0.H一 O-H.OH,7+ 2.47 HBr.4H,O 中心H,O被两 H,O 2.50 [H,O;KH,O,] 个H,O和一个Br H 2Br.HO 按三角锥形配位 H,O OH, 1+ 2.51 [H,O,1CI. 中心H,O被三 2H,O H H 两个2.54 个H,O按三角 锥形配位 H,O H OH, 16 止页下页 节首节尾
16

5.1.4溶剂的拉平效应(leveling effect of solvent) HAc HCN 酸碱的相对强弱的比较(指水中) K 1.8×105 5.8×10-10 拉平效应:溶剂将酸或碱的强度拉平的作用,称为溶剂的“拉平效应”, 例如,在水中进行的任何实验都不能告诉我们HCI和HBr, 哪一种酸性更强些 区分效应:用一个溶剂能把酸或碱的相对强弱区分开来,称为溶剂的 “区分效应”,如以冰醋酸为溶剂,则就可以区分开下列酸 的强弱。 HI>HCIO>HCI>H,SO>HNO 同样,酸越强,其共轭碱越弱;碱越强,其共轭酸越弱, 酸性:HCIO>H2SO4>HPO4>HAc>H2CO3>NH>HO 碱性:CIO<HSO<HPO4<Ac<HCO<NH3<OH 17 上页下页 节首 节尾
17 5.1.4 溶剂的拉平效应(leveling effect of solvent) θ 5 10 a 1.8 10 5.8 10 HAc HCN K 区分效应:用一个溶剂能把酸或碱的相对强弱区分开来,称为溶剂的 “区分效应”. 如以冰醋酸为溶剂,则就可以区分开下列酸 的强弱. 拉平效应:溶剂将酸或碱的强度拉平的作用,称为溶剂的“拉平效应”. 例如,在水中进行的任何实验都不能告诉我们HCl和HBr, 哪一种酸性更强些. 4 HC H 2 SO 4 HNO3 HIHClO l 酸碱的相对强弱的比较(指水中) 同样,酸越强,其共轭碱越弱;碱越强,其共轭酸越弱. ClO HSO H PO Ac HCO NH OH HClO H SO H PO HAc H CO NH H O 4 4 2 4 3 3 4 2 4 3 4 2 3 4 2 碱性: 酸性:

5.1.5羟基酸(hydroxy acid) 水溶液中最重要的布朗斯特酸是那些能给出其羟基质子的酸, 羟基酸均含氧原子,因而又叫含氧酸.布朗斯特平衡中能够给出的 质子叫酸质子,以便与分子或离子中可能存在的其他质子相区分 (1)水合酸的分类 水合酸水合酸的酸质子处在与金属离子配位的水分子中,例 如Fe(H2O)63+.相应的布朗斯特平衡为: [Fe(H2O)3+H2O(I)=[Fe(H2O)s(OH)2+H3O+(aq) OH. ■3+ H2O H,O OH, OH 18 止页 下页 节首 节尾
18 5.1.5 羟基酸 (hydroxy acid) 水溶液中最重要的布朗斯特酸是那些能给出其羟基质子的酸. 羟基酸均含氧原子,因而又叫含氧酸. 布朗斯特平衡中能够给出的 质子叫酸质子,以便与分子或离子中可能存在的其他质子相区分. (1) 水合酸的分类 ● 水合酸 水合酸的酸质子处在与金属离子配位的水分子中, 例 如[Fe(H2O)6] 3+.相应的布朗斯特平衡为 : [Fe(H2O)6] 3+ + H2O(l) == [Fe(H2O)5(OH)] 2+ H3O+(aq)
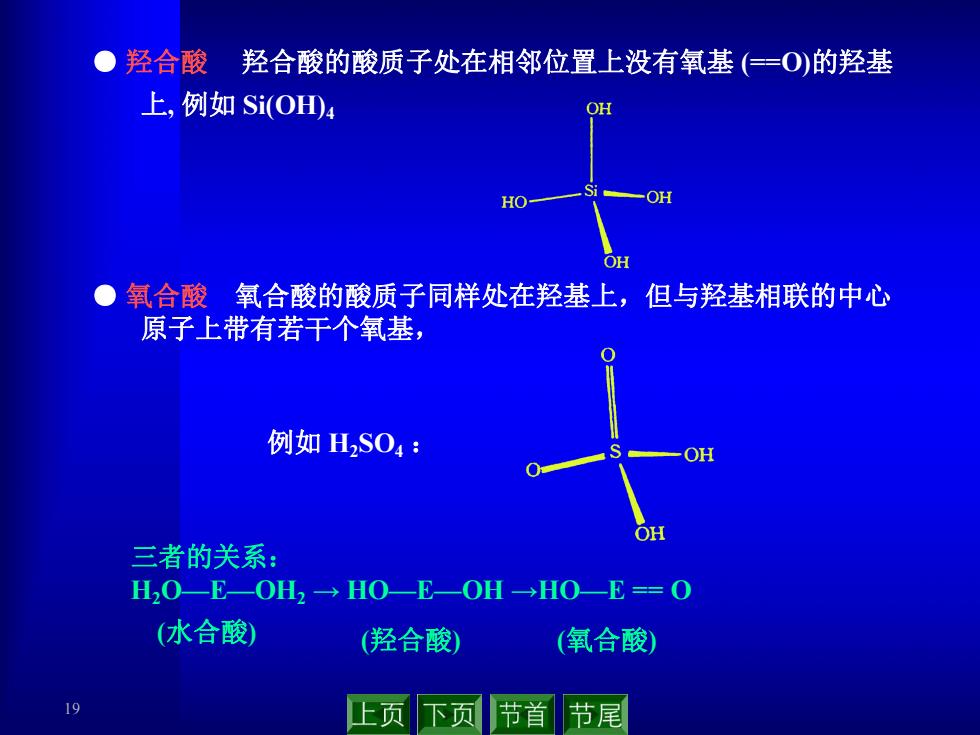
●羟合酸羟合酸的酸质子处在相邻位置上没有氧基(仁=O)的羟基 上,例如Si(OH4 OH S HO- -OH OH 氧合酸氧合酸的酸质子同样处在羟基上,但与羟基相联的中心 原子上带有若干个氧基 例如H2S04: OH OH 三者的关系: H20E—OH2→HO-E-OH→H0-E=0 (水合酸) (羟合酸) (氧合酸) 19 上页 下页 节首 节尾
19 ● 羟合酸 羟合酸的酸质子处在相邻位置上没有氧基 (==O)的羟基 上, 例如 Si(OH)4 ● 氧合酸 氧合酸的酸质子同样处在羟基上,但与羟基相联的中心 原子上带有若干个氧基, 三者的关系: H2O—E—OH2 → HO—E—OH →HO—E == O (羟合酸) (氧合酸) (水合酸) 例如 H2SO4 :
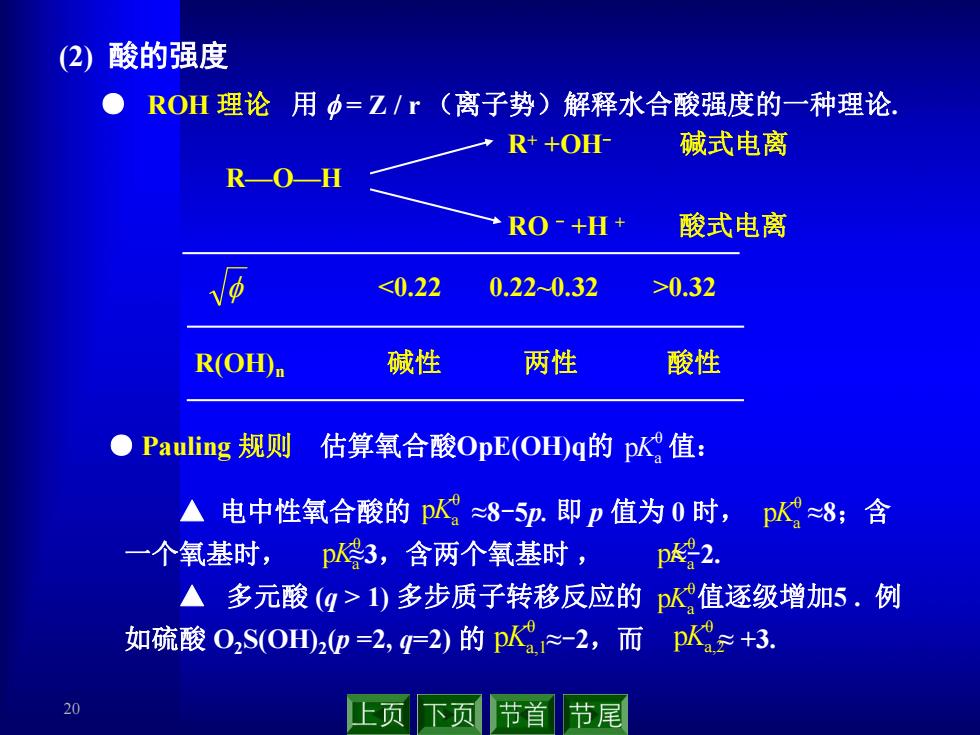
(2)酸的强度 ROH理论用中=Z/“(离子势)解释水合酸强度的一种理论. R++OH- 碱式电离 R-OH RO-+H+ 酸式电离 <0.22 0.220.32 >0.32 R(OH)n 碱性 两性 酸性 ●Pauling规则估算氧合酸OpE(OH山g的p值: ▲电中性氧合酸的p≈8-5p.即p值为0时,p≈8;含 一个氧基时, p3,含两个氧基时, p号2. ▲多元酸(q>1)多步质子转移反应的p值逐级增加5.例 如硫酸02S(0川2p=2,q2)的pK1≥-2,而p以≥+3. 20 上页下节首节尾
20 (2) 酸的强度 ● ROH 理论 用 f = Z / r (离子势)解释水合酸强度的一种理论. <0.22 0.22~0.32 >0.32 R(OH)n 碱性 两性 酸性 f R+ +OH- 碱式电离 R—O—H RO - +H + 酸式电离 ● Pauling 规则 估算氧合酸OpE(OH)q的 pKa θ 值: ▲ 电中性氧合酸的 ≈8-5p. 即 p 值为 0 时, ≈8;含 一个氧基时, ≈3,含两个氧基时 , ≈-2. ▲ 多元酸 (q > 1) 多步质子转移反应的 值逐级增加5 . 例 如硫酸 O2S(OH)2(p =2, q=2) 的 ≈-2,而 ≈ +3. θ a pK θ a,1 pK θ a,2 pK θ a pK θ a pK θ a pK θ a pK