
第7章 化学动力学基础 Pismary of Chencalgractan Kincties
第7章 化学动力学基础 Chapter 7 Primary of Chemical Reaction Kinetics

本章要求 1、建立反应速度的概 念。 2、理解速率方程(质 量作用定律)和阿仑尼 乌斯方程; 3、初步理解反应机理 (反应历程)的概念; 4、理解解释基元反应 的速率方程的碰撞理 论和解释阿仑尼乌斯 方程的过渡态理论; 随着空气中的二氧化硫的浓度的增 5、简介催化反应。 加使得酸雨的浓度也在增加.结果,文物 被腐蚀的速度也在加快。 止页下节首节尾
2 随着空气中的二氧化硫的浓度的增 加使得酸雨的浓度也在增加.结果,文物 被腐蚀的速度也在加快. 本章要求 1、建立反应速度的概 念。 2、理解速率方程(质 量作用定律)和阿仑尼 乌斯方程; 3、初步理解反应机理 (反应历程)的概念; 4、理解解释基元反应 的速率方程的碰撞理 论和解释阿仑尼乌斯 方程的过渡态理论; 5、简介催化反应

7,1化学反应速率 7.2浓度对化学反应的影响 7.3 温度对反应速率的的影响及阿仑尼乌斯公式 7.4反应历程 7.5 碰撞理论和过渡态理论 7.6催化剂对反应速度的影响 章首 结束
7.1 化学反应速率 7.3 温度对反应速率的的影响及阿仑尼乌斯公式 7.2 浓度对化学反应的影响 7.4 反应历程 7.5 碰撞理论和过渡态理论 7.6 催化剂对反应速度的影响
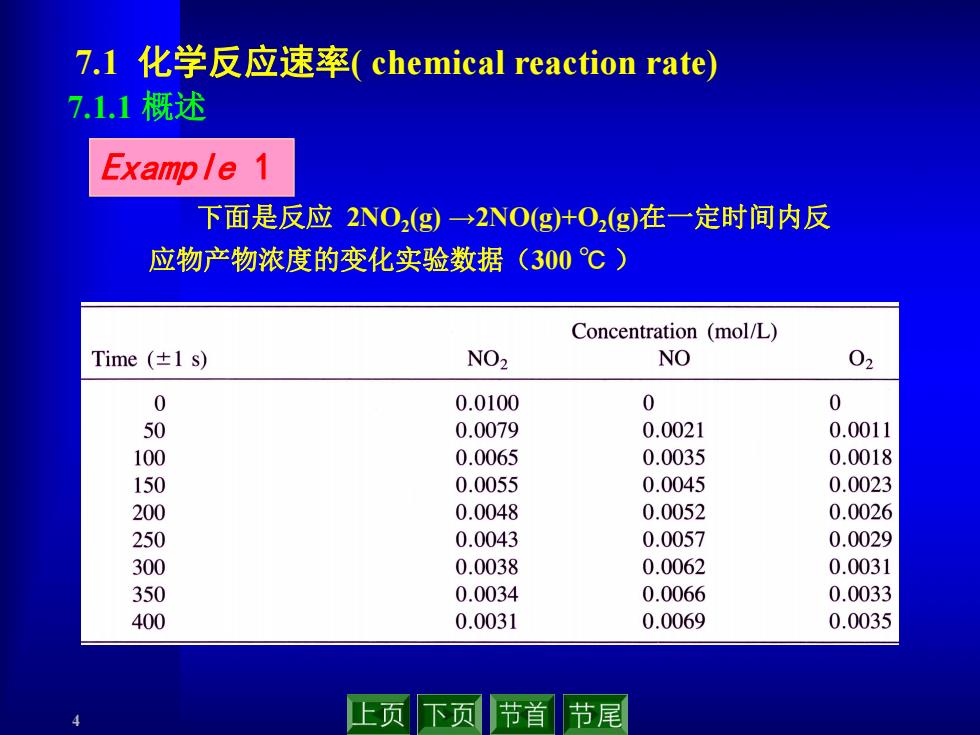
7.l化学反应速率(chemical reaction rate) 7.1.1概述 Example 1 下面是反应2NO2(g)→2NO(g+O2g)在一定时间内反 应物产物浓度的变化实验数据(300℃) Concentration (mol/L) Time(±1s) NO2 NO 02 0 0.0100 0 0 50 0.0079 0.0021 0.0011 100 0.0065 0.0035 0.0018 150 0.0055 0.0045 0.0023 200 0.0048 0.0052 0.0026 250 0.0043 0.0057 0.0029 300 0.0038 0.0062 0.0031 350 0.0034 0.0066 0.0033 400 0.0031 0.0069 0.0035 上页 下页 节首 节尾
4 7.1 化学反应速率( chemical reaction rate) 下面是反应 2NO2(g) →2NO(g)+O2(g)在一定时间内反 应物产物浓度的变化实验数据(300 ℃ ) Example 1 7.1.1 概述
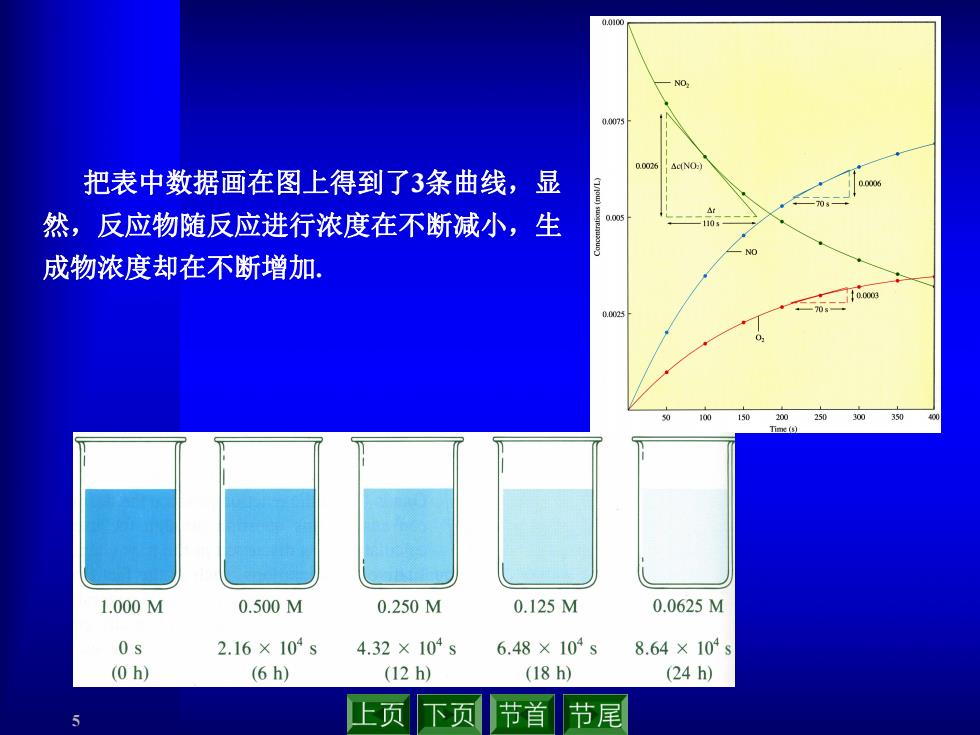
0.010m 把表中数据画在图上得到了3条曲线,显 然,反应物随反应进行浓度在不断减小,生 成物浓度却在不断增加. 1.000M 0.500M 0.250M 0.125M 0.0625M 0s 2.16×104s 4.32×104s 6.48×104s 8.64×104s (0h) (6h) (12h) (18h) (24h) 上页 下页 节首 节尾
5 把表中数据画在图上得到了3条曲线,显 然,反应物随反应进行浓度在不断减小,生 成物浓度却在不断增加