
5.1.1 定义(definition) 1923年由Bronsted J N和LowryTM提出: 酸:反应中任何能给出质子的分子或离子,即质子给予体 碱:反应中任何能接受质子的分子或离子,即质子接受体 酸碱反应是指质子由质子给予体向质子接受体的转移过程 由于该定义不涉及发生质子转移的环境,故而在气相和任何溶 剂中均通用. HF(g)+H2O(1)H;O+(ag)+F-(ag) HF(ag)+NH3(ag)NH"(ag)+F-(ag) 水 H2O(1)+NH;(ag)-OH-(ag)+NHa"(ag) 两性 H2S(ag)+H2O(1)H3O+(ag)+H3S+(ag) 上页下页 节首 节尾
6 酸:反应中任何能给出质子的分子或离子,即质子给予体 碱:反应中任何能接受质子的分子或离子,即质子接受体 酸碱反应是指质子由质子给予体向质 子接受体的转移过程 5.1.1 定义(definition) 1923年由Brfnsted J N和Lowry TM提出: 由于该定义不涉及发生质子转移的环境,故而在气相和任何溶 剂中均通用. HF(g) + H2O(l) →H3O+(ag) + F-(ag) HF(ag) + NH3(ag) →NH4 +(ag) + F-(ag) H2O(l) + NH3(ag) →OH-(ag) + NH4 +(ag) H2S(ag) + H2O (l) →H 3O+ (ag) + H4S+(ag) 水 是 两 性
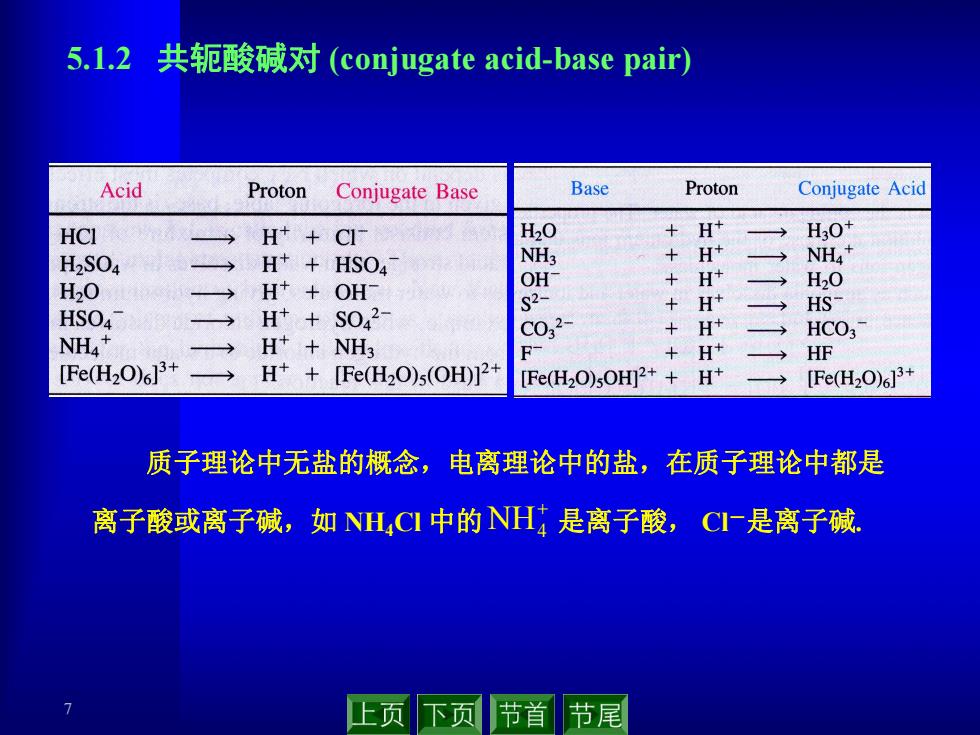
5.l.2共轭酸碱对(conjugate acid-.base pair) Acid Proton Conjugate Base Base Proton Conjugate Acid HCI H++C1 H20 + H+ H30 H2SO4 H+HSO4 NH3 H+ NH4+ H20 H++OHΓ OH +H+ H20 S2- HS HSO4 H++S042 +H+ → C032- H+ HCO3 NHA* 二 H++NH3 F +H+ HF [Fe(H2O)63+ H*+[Fe(H2O)s(OH)]2+ [Fe(H2O)sOH]2++ H+ [Fe(H2O)6]3+ 质子理论中无盐的概念,电离理论中的盐,在质子理论中都是 离子酸或离子碱,如NH,CI中的NH是离子酸,C一是离子碱 止页下页 节首节尾
7 5.1.2 共轭酸碱对 (conjugate acid-base pair) 质子理论中无盐的概念,电离理论中的盐,在质子理论中都是 离子酸或离子碱,如 NH4Cl 中的 是离子酸, Cl-是离子碱. NH4

(1)酸碱反应的实质 两个共轭酸碱对之间的质子传递 H H)-CI:+:N-H H-N-H+:Cl: H H HCI NH3 之 NH4+ CI Acid Base2 Acid2 Base 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 ●反应总是由相对较强的酸和碱向生成相对较弱的酸和碱的方向进行 ● 对于某些物种而言,是酸是碱取决于参与的具体反应 上页下页 节首 节尾
8 两个共轭酸碱对之间的质子传递 ● 酸越强,其共轭碱越弱;碱越强,其共轭酸越弱 ● 反应总是由相对较强的酸和碱向生成相对较弱的酸和碱的方向进行 ● 对于某些物种而言,是酸是碱取决于参与的具体反应 (1)酸碱反应的实质
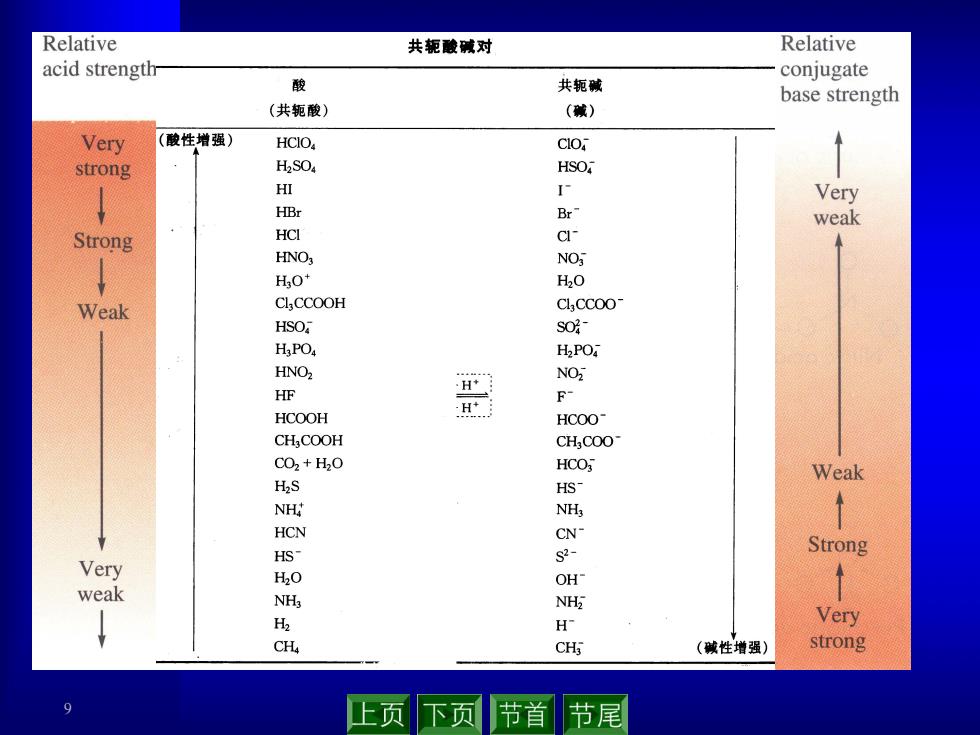
Relative 共轭酸碱对 Relative acid strength conjugate 酸 共轭碱 base strength (共轭酸) (碱) Very (酸性增强) HCIO, CIO strong H2S04 HSO ↑ HI I Very HBr Br weak Strong HCI c HNO NO H3O* H2O Weak ClCCOOH ClCCOo HSO sO HPO H2PO HNO2 NO HF H HCOOH F HCOO CH,COOH CHCOO CO2+H2O HCO Weak H2S HS NH NHs HCN CN HS Strong Very s2- H2O OH weak NHs NH2 ↓ H H Very CH CHi (碱性增强) strong 9 上页下页 节首 节尾
9

(2)酸碱反应的类型 ●酸和碱的离解反应 + H H ⑩-C1:+:O-H≥ H-O-H+:CI: HCI H20 公 H3O* CI Acid Base2 Acid, Base H H H O-④+:N-H H一N一H +H-0: H H H20+ NH3 NH4* OH Acid Base Acid, Base H H H 0-+:0-H 三 H-0-H+H-0: H20+ H2O H3O* + OH Acid Base2 Acid, Base 10 止页 下页 节首 节尾
10 (2)酸碱反应的类型 ● 酸和碱的离解反应