
导航 学思考发现 在100mL1moL1Fez(S04)3溶液中,c(Fe3+)、c(So子)分别 为多少?两者有何关系? 提示:c(Fe3+)=2moL1、c(S0子)=3moL1。c(Fe3+)与c(S0子)的 比值与化学式组成中离子个数比相等
导航 在100 mL 1 mol·L-1 Fe2 (SO4 )3溶液中,c(Fe3+)、c( )分别 为多少?两者有何关系? S𝐎𝟒 𝟐- 提示:c(Fe3+)=2 mol·L-1 、c(S𝐎𝟒 𝟐- )=3 mol·L-1 。c(Fe3+)与 c(S𝐎𝟒 𝟐- )的 比值与化学式组成中离子个数比相等
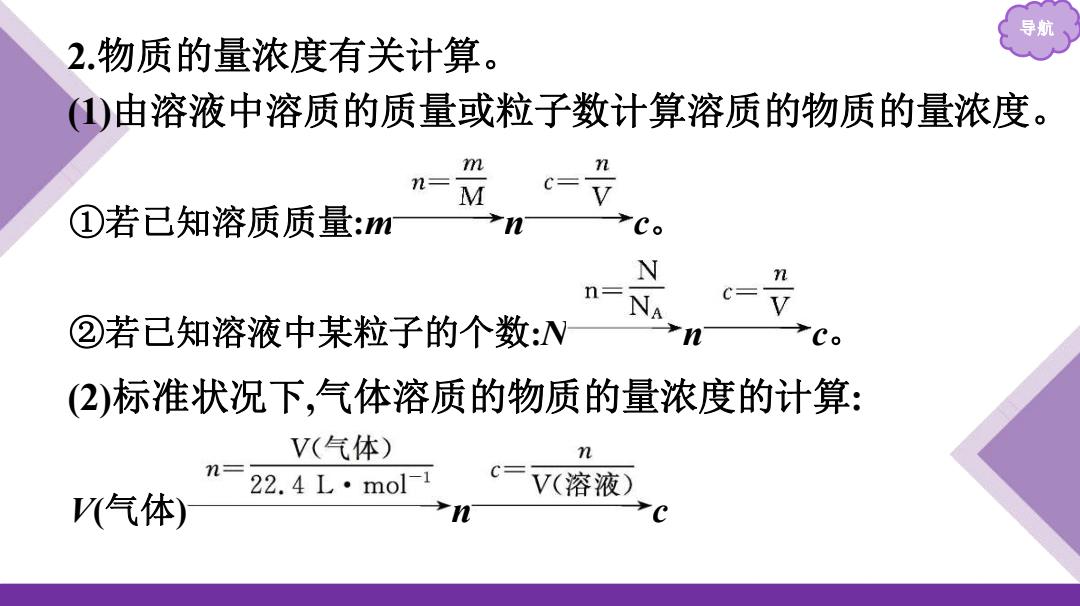
2.物质的量浓度有关计算。 )由溶液中溶质的质量或粒子数计算溶质的物质的量浓度。 m n= C=V ①若已知溶质质量:m Co N n= ②若已知溶液中某粒子的个数:N (2)标准状况下,气体溶质的物质的量浓度的计算: V(气体) n 22.4L·mol-1 c=V(溶液) V气体)
导航 2.物质的量浓度有关计算。 (1)由溶液中溶质的质量或粒子数计算溶质的物质的量浓度。 ①若已知溶质质量:m n c。 ②若已知溶液中某粒子的个数:N n c。 V(气体) n c (2)标准状况下,气体溶质的物质的量浓度的计算:

导航 (3)物质的量浓度与溶质的质量分数的换算: ①换算公式。 10o0mL:L×p"(c的单位为molL,其中M为溶质的摩尔质量 M (单位为gmol)p为溶液的密度(单位为gcm3),w为溶质的质量分 数
导航 (3)物质的量浓度与溶质的质量分数的换算: ①换算公式。 c= 𝟏 𝟎𝟎𝟎 𝐦𝐋·𝐋 -𝟏 ×𝝆𝒘 𝑴 (c 的单位为 mol·L-1 ),其中 M 为溶质的摩尔质量 (单位为 g·mol-1 ),ρ 为溶液的密度(单位为 g·cm-3 ),w 为溶质的质量分 数

导航 ②推导方法。 设溶液体积为1L,则 a.溶质的质量:e1L×1000mLL1XpXw =1000 nLXpw(m的单位为g) b溶质的物质的量:m对 =1000 mLxpw M 1000mL×pw c溶质的物质的量浓度:= M 1000mLL-1×pw 1L M
导航 ②推导方法。 设溶液体积为1 L,则 a.溶质的质量:m=1 L×1 000 mL·L-1×ρ ×w =1 000 mL×ρw(m的单位为g) b.溶质的物质的量:n= 𝒎 𝑴 = 𝟏 𝟎𝟎𝟎 𝐦𝐋×𝝆𝒘 𝑴 c.溶质的物质的量浓度:c= 𝒏 𝑽 = 𝟏 𝟎𝟎𝟎 𝐦𝐋×𝝆𝒘 𝑴 𝟏 𝐋 = 𝟏 𝟎𝟎𝟎 𝐦𝐋·𝐋 -𝟏 ×𝝆𝒘 𝑴