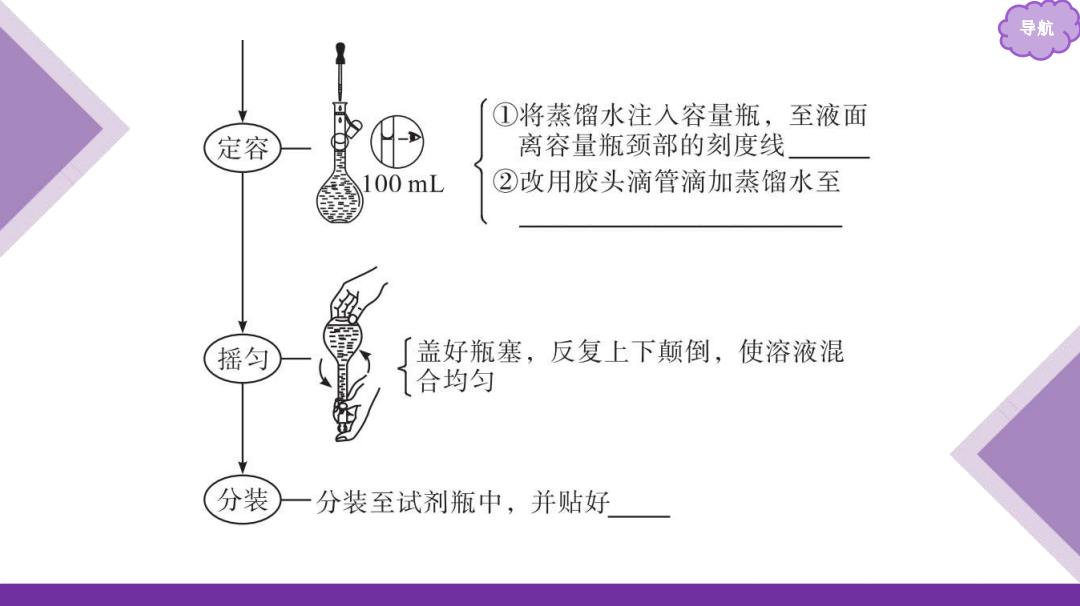
导航 ①将蒸馏水注入容量瓶,至液面 定容 离容量瓶颈部的刻度线 00 mL 7 ②改用胶头滴管滴加蒸馏水至 摇匀 盖好瓶塞,反复上下颠倒,使溶液混 合均匀 分装 一分装至试剂瓶中,并贴好
导航

导航 3.浓溶液的稀释。 稀释公式:
导航 3.浓溶液的稀释。 稀释公式: c(浓溶液)·V(浓溶液)= c(稀溶液)·V(稀溶液)

微判断(1)用固体配制溶液时,可直接将固体在容量瓶中进 行溶解。(×) (2)实验室需要950mL0.1moL1的NaCI溶液,配制时应选 用1000mL容量瓶。(√) 3)洗净的容量瓶要放进烘箱中烘干。(×) (4)配制0.1000moL1氯化钠溶液时,将液体转移到容量瓶 中需用玻璃棒引流。(√) (⑤)配制一定物质的量浓度的溶液时,若液面超过刻度线,应 立即用胶头滴管吸出多的部分。(X)
导航 微判断(1)用固体配制溶液时,可直接将固体在容量瓶中进 行溶解。( ) (2)实验室需要950 mL 0.1 mol·L-1的NaCl溶液,配制时应选 用1 000 mL容量瓶。( ) (3)洗净的容量瓶要放进烘箱中烘干。( ) (4)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶 中需用玻璃棒引流。( ) (5)配制一定物质的量浓度的溶液时,若液面超过刻度线,应 立即用胶头滴管吸出多的部分。( ) × √ × √ ×

导航 课堂·重难突破 有关物质的量浓度的理解及简单计算 重难归纳 1.计算物质的量浓度时的“五注意”。 (1)溶质用物质的量表示,而不是质量。如给出的条件是溶 质的质量或气体的体积等,应根据有关公式换算为物质的量。 (2)表示溶液的体积,而不是溶剂的体积,单位一般用“L”,也 可用其他单位,但要注意单位的换算和统一
导航 一 有关物质的量浓度的理解及简单计算 重难归纳 1.计算物质的量浓度时的“五注意” 。 (1)溶质用物质的量表示,而不是质量。如给出的条件是溶 质的质量或气体的体积等,应根据有关公式换算为物质的量。 (2)V表示溶液的体积,而不是溶剂的体积,单位一般用“L”,也 可用其他单位,但要注意单位的换算和统一。 课堂·重难突破

3)由于溶液具有均一性,对于一定物质的量浓度的溶液来 说,从中取出任意体积的溶液,物质的量浓度不变,但其中所含 溶质的物质的量与所取溶液体积有关。 (4)整体与部分的关系:如0.1moL1A1C3溶液中, c(A3+)=0.1molL1,c(C)=0.3moL1。 (⑤)带有结晶水的物质作为溶质时,其“物质的量”的计算:用 带有结晶水的物质的质量除以带有结晶水的物质的摩尔质量
导航 (3)由于溶液具有均一性,对于一定物质的量浓度的溶液来 说,从中取出任意体积的溶液,物质的量浓度不变,但其中所含 溶质的物质的量与所取溶液体积有关。 (4)整体与部分的关系:如0.1 mol·L-1 AlCl3溶液中, c(Al3+ )=0.1 mol·L-1 ,c(Cl- )=0.3 mol·L-1 。 (5)带有结晶水的物质作为溶质时,其“物质的量”的计算:用 带有结晶水的物质的质量除以带有结晶水的物质的摩尔质量