
全程设计 第二节 金属材料 第2课时 物质的量在化学方程式计算中 的应用
第二节 金属材料 第2课时 物质的量在化学方程式计算中 的应用

课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随 堂 训 练
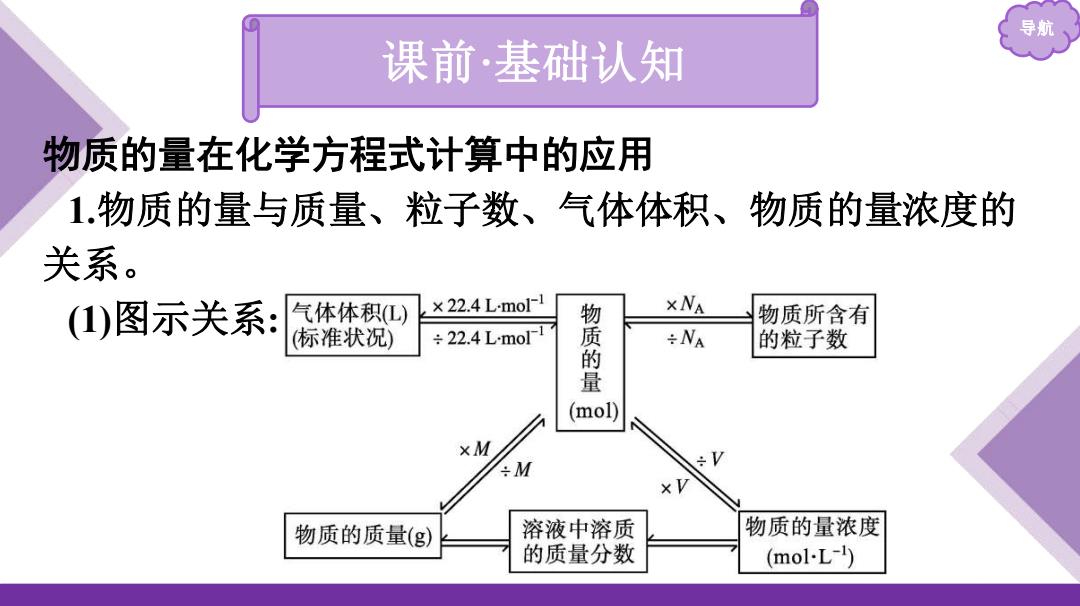
导 课前·基础认知 物质的量在化学方程式计算中的应用 1.物质的量与质量、粒子数、气体体积、物质的量浓度的 关系。 ()图示关系: 气体体积L) ×22.4LmolΓ1 xNA 物质所含有 (标准状况) ÷22.4Lmol 物质的 ÷NA 的粒子数 (mol) xM ÷M 物质的质量(g〉 溶液中溶质 物质的量浓度 的质量分数 (mol-L-1)
导航 物质的量在化学方程式计算中的应用 1.物质的量与质量、粒子数、气体体积、物质的量浓度的 关系。 (1)图示关系: 课前·基础认知

导航 2)计算公式: ①已知物质的质量:n(B)-m: M(B) ②已知标准状况时的气体体积:B)VB到; ③已知物质的粒子数:n(B) N(B) NA ④已知溶液中的物质的量浓度:
导航 (2)计算公式: ①已知物质的质量:n(B)=𝒎(𝐁) 𝑴(𝐁) ; ②已知标准状况时的气体体积:n(B)=𝑽[𝐁(𝐠)] 𝑽 𝐦 ; ③已知物质的粒子数:n(B)=𝑵(𝐁) 𝑵𝐀 ; ④已知溶液中的物质的量浓度: n(B)=c(B)·V[B(aq)]

2.化学方程式是表示物质间发生化学反应的式子,它必须遵 循 守恒定律。在化学方程式中,可反映出物质的质 量关系、粒子数目关系、物质的量关系等 设N表示阿伏加德罗常数的值。在化学方程式中存在如下 关系: 2Na+2H,0=2Na0H+H2↑ 质量之比 46g:36g 80g:2g 化学计量数之比2 扩大N倍 2NA 物质的量之比 2 mol
导航 2.化学方程式是表示物质间发生化学反应的式子,它必须遵 循 质量 守恒定律。在化学方程式中,可反映出物质的质 量关系、粒子数目关系、物质的量关系等。 设NA表示阿伏加德罗常数的值。在化学方程式中存在如下 关系: 2Na + 2H2O══2NaOH+H2↑ 质量之比 46 g ∶ 36 g ∶ 80 g ∶2 g 化学计量数之比2 ∶ 2 ∶ 2 ∶ 1 扩大NA倍 2NA ∶2NA ∶ 2NA ∶ NA 物质的量之比 2 mol ∶ 2 mol ∶ 2 mol ∶1 mol