
热力学第一定律 习题辅导
热力学第一定律 习题辅导

·体积功的主要计算公式: W=-Jp外dV 功的通用计算公式 ·1.理想气体等温可逆过程: W=jw-兴'wRT
• 体积功的主要计算公式: W=-p外dV 功的通用计算公式 • 1. 理想气体等温可逆过程: 2 1 V 1 V 2 nRT V W pdV dV nRTln V V = − = − =

2.等外压过程: W=-∫PdV=-p外∫dV=-P外(V,-V) 理想气体外压恒等于体系末态压力的 等温过程: W=-p2(V2-V)=-nRT,+p2 nRT=nRT(Pz-1) 3.自由膨胀过程: P外=0, 有:W=0
3. 自由膨胀过程: p外=0, 有: W=0 2. 等外压过程: W p dV p dV p (V V ) = − = − = − − 外 外 外 2 1 理想气体外压恒等于体系末态压力的 等温过程: 1 2 2 2 1 2 2 1 1 nRT p W p (V V ) nRT p nRT( 1) p p = − − = − + = −
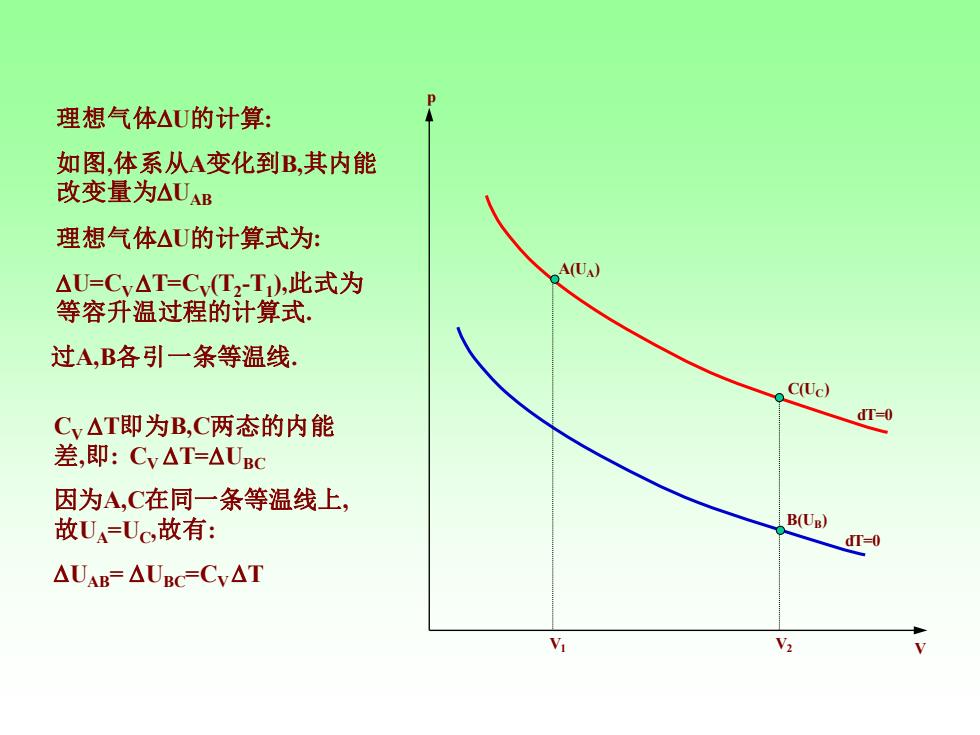
理想气体△U的计算: 如图,体系从A变化到B,其内能 改变量为△UAB 理想气体△U的计算式为: △U=Cy△T=Cv(T2-T),此式为 A(UA) 等容升温过程的计算式: 过A,B各引一条等温线, C(Uc) Cy△T即为B,C两态的内能 dT-0 差,即:Cy△T=△UBC 因为A,C在同一条等温线上, 故U=Uc,故有: B(Ug) dT=0 △UAB=△UBC=Cv△T
p V dT=0 dT=0 C(U C) V 1 V2 A(UA) B(UB) 理想气体 U的计算 : 如图 ,体系从 A变化到B,其内能 改变量为 UAB 理想气体 U的计算式为 : U=CV T=C V(T 2 - T 1 ),此式为 等容升温过程的计算式. 过A,B各引一条等温线. CV T即为B,C两态的内能 差,即: CV T=UBC 因为A,C在同一条等温线上 , 故 U A=U C ,故有 : UAB= UBC=CV T
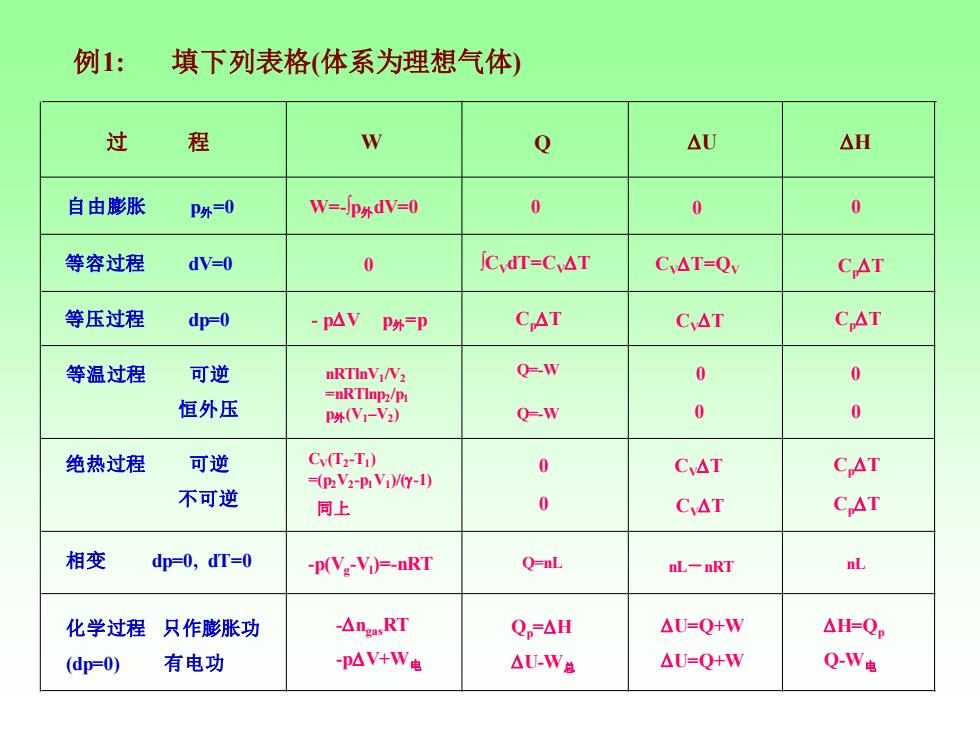
例1: 填下列表格(体系为理想气体) 过 程 Q △U △H 自由膨胀 P外=0 W=-p外dV=0 0 0 0 等容过程 dV=0 0 jCdT=Cv△T CyAT=Qv CAT 等压过程 dp=0 -pAV P外=P CAT CAT CAT 等温过程 可逆 nRTInVNV2 Q-W 0 0 恒外压 =nRTInp2/p P(N1-V2) Q-W 0 0 绝热过程 可逆 Cy(Tz-T1) 0 CyAT =(pz V2-Pr Vi)(Y-1) CAT 不可逆 同上 0 CAT CAT 相变 dp=0,dT=0 -p(V:-Vi)=-nRT Q=nL nL-nRT nL 化学过程只作膨胀功 -△ngasRT Qp=AH △U-Q+W △H=Qp (dp=0) 有电功 -pAV+W电 △U-W总 △U=Q+W QW电
例1: 填下列表格(体系为理想气体) 过 程 W Q U H 自由膨胀 p外=0 等容过程 dV=0 等压过程 dp=0 等温过程 可逆 恒外压 绝热过程 可逆 不可逆 相变 dp=0, dT=0 化学过程 只作膨胀功 (dp=0) 有电功 nRTlnV1 /V2 =nRTlnp2 /p1 p外(V1–V2 ) W=-∫p外dV=0 0 0 0 0 0 0 0 0 0 0 ∫CVdT=CVT CVT=QV CpT - pV p外=p CpT CVT CpT Q=-W Q=-W CV(T2 -T1 ) =(p2V2 -p1V1 )/(-1) 同上 CVT CVT CpT CpT -p(Vg -Vl )=-nRT Q=nL nL-nRT nL -ngasRT -pV+W电 Qp=H U-W总 U=Q+W U=Q+W H=Qp Q-W电