
③乙炔的元键 sp 乙炔的每个碳原子还各有两个相互垂直的 未参加杂化的p轨道,不同碳原子的p轨道又 是相互平行的 一个碳原子的两个轨道和另一个碳原子 p sp 对应的两个p轨道,在侧面交盖形成两个碳 碳π键, 5Dpg键
• 乙炔的每个碳原子还各有两个相互垂直的 未参加杂化的p轨道, 不同碳原子的p轨道又 是相互平行的. • 一个碳原子的两个p轨道和另一个碳原子 对应的两个p轨道,在侧面交盖形成两个碳 碳键. ③乙炔的键

电子云对称分布于碳碳σ键键轴周围的,类似圆 筒形状的π电子云 ④不同杂化轨道的比较 SD3 sp
• 电子云对称分布于碳碳 键键轴周围的,类似圆 筒形状的 电子云. ④不同杂化轨道的比较
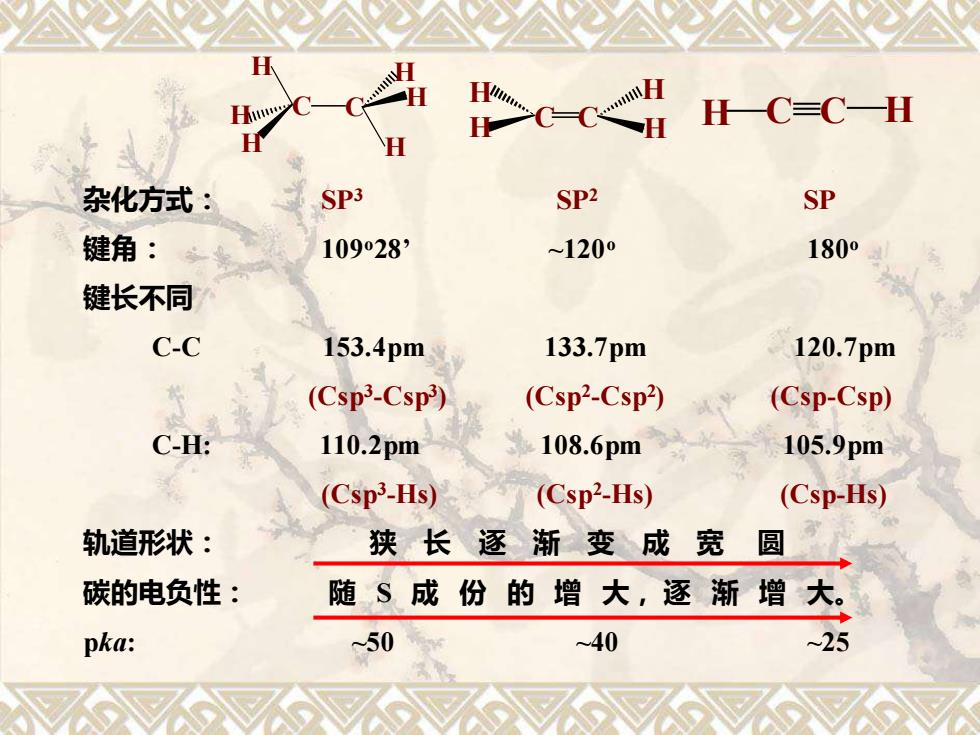
H C C=C—H 杂化方式: SP3 SP2 SP 键角: 10928 ~1200 1800 键长不同 C-C 153.4pm 133.7pm 120.7pm (Csp3-Csp) (Csp2-Csp2) (Csp-Csp) C-H: 110.2pm 108.6pm 105.9pm (Csp3-Hs) (Csp2-Hs) (Csp-Hs) 轨道形状: 狭长逐渐变成宽 圆 碳的电负性: 随S成份的增大,逐渐增大。 pka: ~50 ~40 ~25
杂化方式: SP3 SP2 SP 键角: 109o28’ ~120o 180o 键长不同 C-C 153.4pm 133.7pm 120.7pm (Csp3 -Csp3 ) (Csp2 -Csp2 ) (Csp-Csp) C-H: 110.2pm 108.6pm 105.9pm (Csp3 -Hs) (Csp2 -Hs) (Csp-Hs) 轨道形状: 狭 长 逐 渐 变 成 宽 圆 碳的电负性: 随 S 成 份 的 增 大, 逐 渐 增 大。 pka: ~50 ~40 ~25 C C H H H H H H H H H H C C H C C H
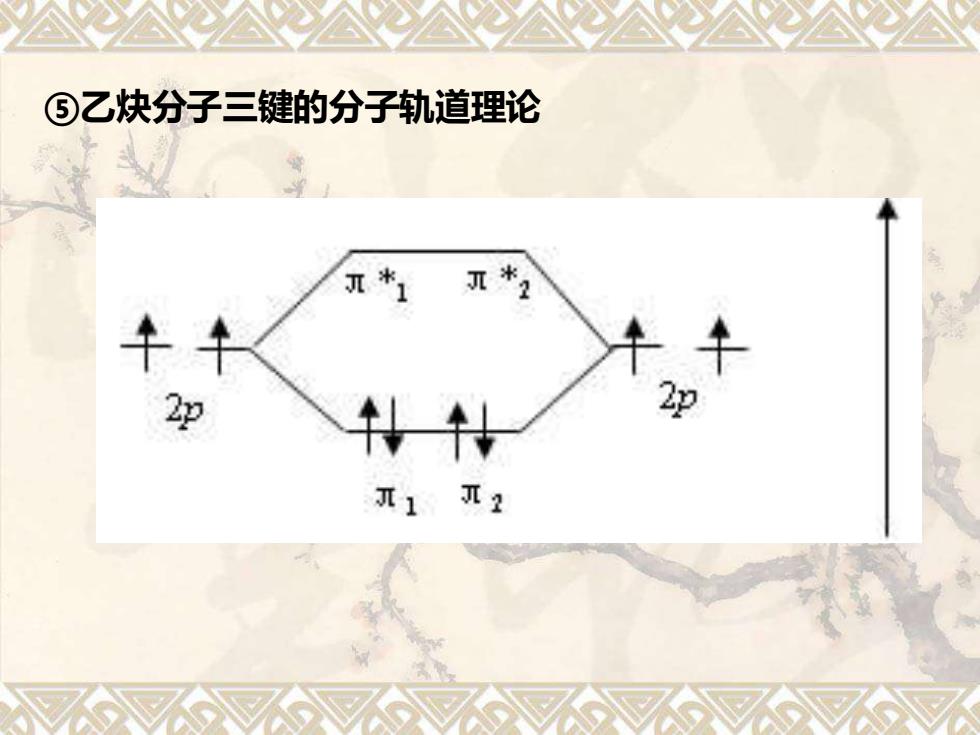
⑤乙炔分子三键的分子轨道理论 *2 2p J2
⑤乙炔分子三键的分子轨道理论

4.2炔烃的异构和命名 4.2.1异构体一从丁炔开始有异构体 同烯烃一样,由于碳链不同和叁键位置不同所引起的由于在 碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比 同碳原子数的烯烃要少, 由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反 异构现象. 戊炔的构造异构体: CH:CH,CH,C=CH CH CHC =CH 1-戊炔 CH, CH3CH,C≡CCH3 3-甲基-1-丁炔 2-戊炔
4.2 炔烃的异构和命名 • 同烯烃一样,由于碳链不同和叁键位置不同所引起的.由于在 碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比 同碳原子数的烯烃要少. • 由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反 异构现象. • 戊炔的构造异构体: CH3CH2CH2C CH CH3CHC CH 1-戊炔 CH3 CH3CH2C CCH3 2-戊炔 3-甲基-1-丁炔 4.2.1 异构体——从丁炔开始有异构体