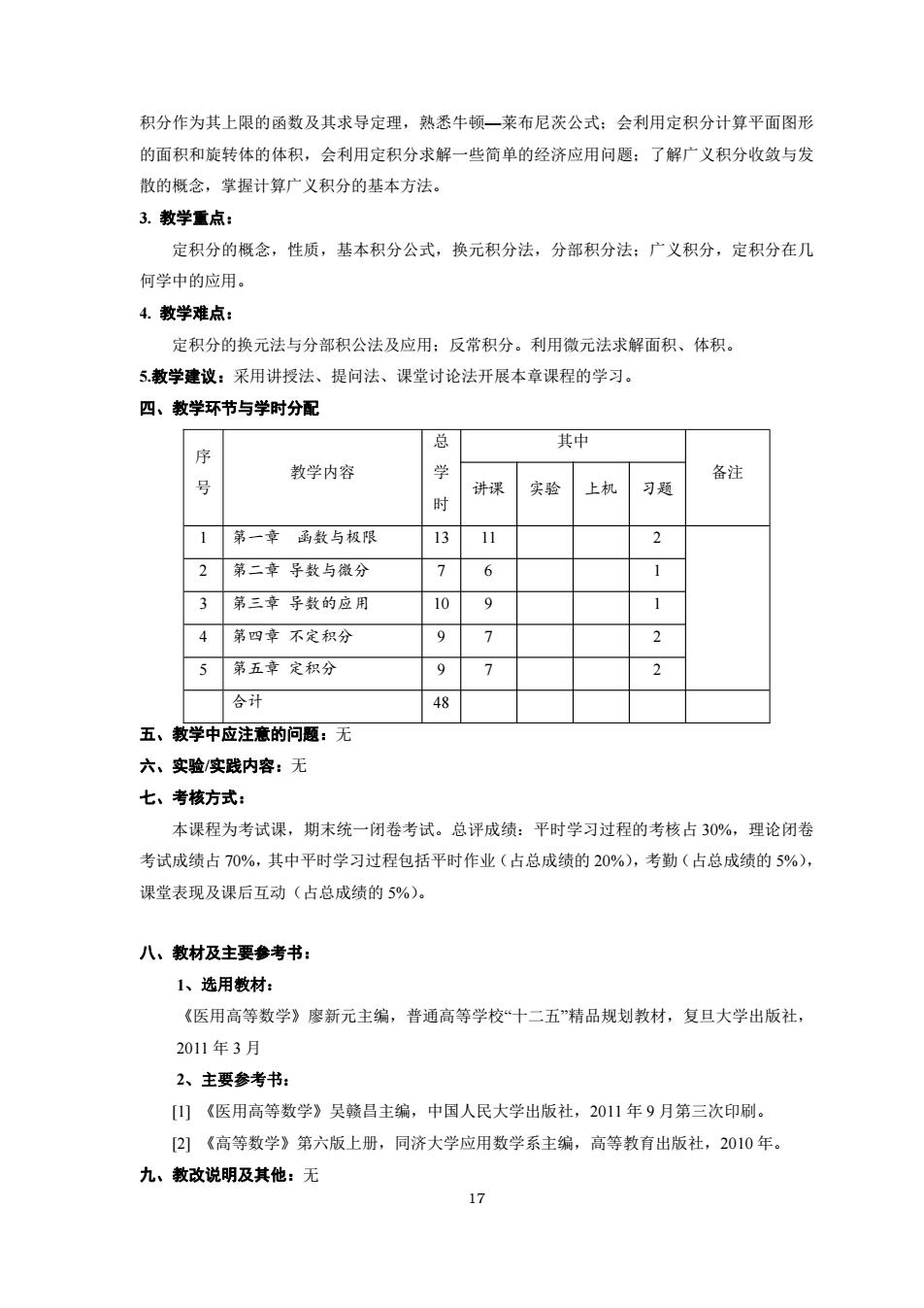
积分作为其上限的函数及其求导定理,熟悉牛顿一莱布尼茨公式:会利用定积分计算平面图形 的面积和旋转体的体积,会利用定积分求解一些简单的经济应用问题:了解广义积分收敛与发 敢的概念,掌握计算广义积分的基本方法 3.教学重点: 定积分的概念,性质,基本积分公式,换元积分法,分部积分法:广义积分,定积分在几 何学中的应用。 4.教学难点: 定积分的换元法与分部积公法及应用:反常积分。利用微元法求解面积、体积。 5教学建议:采用讲授法、提问法、课堂讨论法开展本章课程的学习。 四、教学环节与学时分配 总 序 其中 教学内容 备注 号 讲课 实验 上机 习题 时 1第一章函数与极限 13 2第二章导数与微分 7 3第三章导教的应用 10 4第四章不定积分 9 5第五章定积分 合计 48 五、教学中应注意的问题:无 六、实验/实践内容:无 七、考核方式: 本课程为考试课,期末统一闭卷考试。总评成绩:平时学习过程的考核占30%,理论闭卷 考试成绩占70%,其中平时学习过程包括平时作业(占总成绩的20%),考勤(占总成绩的5%), 课堂表现及课后互动(占总成绩的5%)。 八、教材及主要参考书: 1、选用教材: 《医用高等数学》廖新元主编,普通高等学校“十二五”精品规划教材,复旦大学出版社, 2011年3月 2、主要参考书: [山《医用高等数学》吴赣吕主编,中国人民大学出版社,2011年9月第三次印刷。 2)《高等数学》第六版上册,同济大学应用数学系主编,高等教有出版社,2010年。 九、教改说明及其他:无 17
17 积分作为其上限的函数及其求导定理,熟悉牛顿—莱布尼茨公式;会利用定积分计算平面图形 的面积和旋转体的体积,会利用定积分求解一些简单的经济应用问题;了解广义积分收敛与发 散的概念,掌握计算广义积分的基本方法。 3. 教学重点: 定积分的概念,性质,基本积分公式,换元积分法,分部积分法;广义积分,定积分在几 何学中的应用。 4. 教学难点: 定积分的换元法与分部积公法及应用;反常积分。利用微元法求解面积、体积。 5.教学建议:采用讲授法、提问法、课堂讨论法开展本章课程的学习。 四、教学环节与学时分配 序 号 教学内容 总 学 时 其中 备注 讲课 实验 上机 习题 1 第一章 函数与极限 13 11 2 2 第二章 导数与微分 7 6 1 3 第三章 导数的应用 10 9 1 4 第四章 不定积分 9 7 2 5 第五章 定积分 9 7 2 合计 48 五、教学中应注意的问题:无 六、实验/实践内容:无 七、考核方式: 本课程为考试课,期末统一闭卷考试。总评成绩:平时学习过程的考核占 30%,理论闭卷 考试成绩占 70%,其中平时学习过程包括平时作业(占总成绩的 20%),考勤(占总成绩的 5%), 课堂表现及课后互动(占总成绩的 5%)。 八、教材及主要参考书: 1、选用教材: 《医用高等数学》廖新元主编,普通高等学校“十二五”精品规划教材,复旦大学出版社, 2011 年 3 月 2、主要参考书: [1] 《医用高等数学》吴赣昌主编,中国人民大学出版社,2011 年 9 月第三次印刷。 [2] 《高等数学》第六版上册,同济大学应用数学系主编,高等教育出版社,2010 年。 九、教改说明及其他:无

执笔人:王红勇系室审核人:廖茂新 《无机化学D》课程教学大纲 Inorganic Chemistry D 课程编号:130805048 学时:56学时 学分:3.5学分 适用对像:卫生检验与检疫、生物科学、生物技术等专业。 先修课程:具备高中数理化基础 一、课程的性质和任务 本课程可以支撑毕业要求1、2的达成。《无机化学D》是高等院校卫生检验与检疫、生物 科学、生物技术等专业的第一门化学必修基础课。它既与中学化学内容相衔接,又为后继课程 的学习打下基础,对学生学习起承前启后的作用,是培养上述各类人才的整体知识结构和能力 结构的重要组成部分。该课程可以支撑能力要求第1、2、3条以及素质要求第3条的达成。 本课程的主要任务是使学生掌握溶液、电解质及离子平衡、化学热力学、氧化还原、化学 反应速率、化学平衡及化学反应中能量关系、物质结构理论、配位化合物、电化学及有关计算 等基本理论:并在上述理论的指导下,理解和掌握元素周期表中s、p、d、f各区中重要元素的 单质及其化合物的基本知识,培养分析问题和解决实际问题的能力,使学生具有解决一般无机 化学问题、独立进行化学计算和无机化学实验等方面的能力,为后续课程的学习和今后工作打 下一定的化学基础。 二、教学目的与要求 《无机化学》是卫生检验与检疫、生物科学、生物技术等专业必修的一门专业基础课。它 使学生了解现代无机化学的基本理论,具备必要的无机化学基本理论、基础知识和基本技能, 为后续课程学习和掌握新的科学技术打下必要的基础。 通过本课程学习,要求学生掌握溶液的性质、物质结构的基础理论、化学反应的基本原理、 配位化合物、电化学及有关计算、化学平衡及元素化学的基本知识和实验的基本技能:培养学 生具有独立思考、分析和解决问题的能力。 三、教学内容 第一章:绪论、溶液与胶体 1.基本内容: 溶液组成标度的表示方法,稀溶液的依数性,渗透压在医学上的意义,胶体溶液 2。教学基本要求: 掌握溶液组成标度的各种表示方法和相互换算,稀溶液依数性的概念、有关计算、应用及 渗透压在医学上的意义。 18
18 执笔人:王红勇 系室审核人:廖茂新 《无机化学 D》课程教学大纲 Inorganic Chemistry D 课程编号:130805048 学时:56 学时 学分:3. 5 学分 适用对象:卫生检验与检疫、生物科学、生物技术等专业。 先修课程:具备高中数理化基础 一、课程的性质和任务 本课程可以支撑毕业要求 1、2 的达成。《无机化学 D》是高等院校卫生检验与检疫、生物 科学、生物技术等专业的第一门化学必修基础课。它既与中学化学内容相衔接,又为后继课程 的学习打下基础,对学生学习起承前启后的作用,是培养上述各类人才的整体知识结构和能力 结构的重要组成部分。该课程可以支撑能力要求第 1、2、3 条以及素质要求第 3 条的达成。 本课程的主要任务是使学生掌握溶液、电解质及离子平衡、化学热力学、氧化还原、化学 反应速率、化学平衡及化学反应中能量关系、物质结构理论、配位化合物、电化学及有关计算 等基本理论;并在上述理论的指导下,理解和掌握元素周期表中 s、p、d、f 各区中重要元素的 单质及其化合物的基本知识,培养分析问题和解决实际问题的能力,使学生具有解决一般无机 化学问题、独立进行化学计算和无机化学实验等方面的能力,为后续课程的学习和今后工作打 下一定的化学基础。 二、教学目的与要求 《无机化学》是卫生检验与检疫、生物科学、生物技术等专业必修的一门专业基础课。它 使学生了解现代无机化学的基本理论,具备必要的无机化学基本理论、基础知识和基本技能, 为后续课程学习和掌握新的科学技术打下必要的基础。 通过本课程学习,要求学生掌握溶液的性质、物质结构的基础理论、化学反应的基本原理、 配位化合物、电化学及有关计算、化学平衡及元素化学的基本知识和实验的基本技能;培养学 生具有独立思考、分析和解决问题的能力。 三、教学内容 第一章:绪论、溶液与胶体 1. 基本内容: 溶液组成标度的表示方法,稀溶液的依数性,渗透压在医学上的意义,胶体溶液 2. 教学基本要求: 掌握溶液组成标度的各种表示方法和相互换算,稀溶液依数性的概念、有关计算、应用及 渗透压在医学上的意义

熟悉溶胶的基本性质。 了解大分子溶液和凝胶的基本性质。 3.教学重点难点: 重点:溶液组成标度的表示方法,稀溶液的依数性(蒸汽压下降、凝固点下降、沸点升高 渗透压),渗透压在医学上的应用,溶胶的性质、胶团的结构 难点:稀溶液的依数性 4.教学建议: 使用多媒体授课。 第二章:电解质溶液 1.基本内容: 强电解质溶液理论,酸碱理论,水溶液中质子转移平衡及有关计算 2。教学基本要求: 掌捏酸碱质子理论、质子转移平衡及有关计算。 熟悉强电解质溶液理论:活度、活度系数、离子强度等概念及有关计算。 了解近代酸碱理论。 3.教学重点难点: 重点:酸碱质子理论及其应用:弱酸弱碱的电离常数、有关pH的计算。 难点:强电解质的溶液理论:两性物质pH的计算 4.教学建议: 使用多媒体授课。 第三章:沉淀溶解平衡 1.基本内容: 溶度积常数,沉淀的生成,分步沉淀和沉淀的转化,沉淀的溶解。 2。教学基本要求: 掌握溶度积常数的意义及溶度积与溶解度的相互换算。 掌握溶度积规则及其应用。 熟悉沉淀的生成与转化。 了解沉淀的溶解方法。 3.教学重点难点: 重点:溶度积常数的概念,溶度积和溶解度的相互换算,同离子效应和盐效应,沉淀的生 成,分步沉淀和沉淀的转化 难点:分步沉淀和沉淀的转化 4.教学建议: 使用多媒体授课。 19
19 熟悉溶胶的基本性质。 了解大分子溶液和凝胶的基本性质。 3. 教学重点难点: 重点:溶液组成标度的表示方法,稀溶液的依数性(蒸汽压下降、凝固点下降、沸点升高、 渗透压),渗透压在医学上的应用,溶胶的性质、胶团的结构 难点: 稀溶液的依数性 4. 教学建议: 使用多媒体授课。 第二章:电解质溶液 1. 基本内容: 强电解质溶液理论,酸碱理论,水溶液中质子转移平衡及有关计算 2. 教学基本要求: 掌握酸碱质子理论、质子转移平衡及有关计算。 熟悉强电解质溶液理论:活度、活度系数、离子强度等概念及有关计算。 了解近代酸碱理论。 3. 教学重点难点: 重点:酸碱质子理论及其应用;弱酸弱碱的电离常数、有关 pH 的计算。 难点: 强电解质的溶液理论;两性物质 pH 的计算。 4. 教学建议: 使用多媒体授课。 第三章:沉淀溶解平衡 1. 基本内容: 溶度积常数,沉淀的生成,分步沉淀和沉淀的转化,沉淀的溶解。 2. 教学基本要求: 掌握溶度积常数的意义及溶度积与溶解度的相互换算。 掌握溶度积规则及其应用。 熟悉沉淀的生成与转化。 了解沉淀的溶解方法。 3. 教学重点难点: 重点:溶度积常数的概念,溶度积和溶解度的相互换算,同离子效应和盐效应,沉淀的生 成,分步沉淀和沉淀的转化 难点: 分步沉淀和沉淀的转化 4. 教学建议: 使用多媒体授课

第四章:缓冲溶液 1.基本内容: 缓冲溶液的基本概念,缓冲溶液H计算,缓冲容量,缓冲溶液的配置,缓冲溶液在医学上 的意义。 2.教学基本要求: 了解缓冲作用、缓冲溶液、缓冲对等基本概念。 熟悉缓冲溶液的作用原理。 掌握缓冲溶液的pH计算和配置方法。 3.教学重点难点: 重点:缓冲溶液pH的计算,缓冲容量的概念和影响因素,缓冲溶液的配置 难点:缓冲溶液pH的计算 4.教学建议: 使用多媒体授课。 第五章:化学热力学基础 1.基本内容: 化学热力学基本概念,化学反应的热效应,化学反应的方向和限度,吉布斯自由能变与化 学平衡常数。 2.教学基本要求: 了解内能、格、嫡、吉布斯自由能等热力学基本概念,熟悉状态函数的特点。 掌捏盖斯定律、标准生成烙、标准燃烧烙、标准燃烧热及有关计算。 掌握利用吉布斯自由能判断化学反应方向和限度的方法。 熟悉化学平衡和标准平衡常数的概念,掌握化学反应等温方程式及其应用。 3.教学重点难点: 重点:化学热力学基本概念,热力学第一定律,化学反应的热效应,化学反应热的计算, 热力学第二定律,平衡常数及影响因素。 难点:嫡与箱变,吉布斯自由能判据 4.教学建议: 使用多媒体授课 第六章:化学动力学基础 1.基本内容: 化学反应速率及其表示方法,化学反应速率理论简介,浓度对化学反应速率的影响,温度 对化学反应速率的影响,催化剂对化学反应速率的影响。 2.教学基本要求: 掌握一级反应 二级反应、零级反应和阿累尼乌斯公式的计算及其应用 20
20 第四章:缓冲溶液 1. 基本内容: 缓冲溶液的基本概念,缓冲溶液 pH 计算,缓冲容量,缓冲溶液的配置,缓冲溶液在医学上 的意义。 2. 教学基本要求: 了解缓冲作用、缓冲溶液、缓冲对等基本概念。 熟悉缓冲溶液的作用原理。 掌握缓冲溶液的 pH 计算和配置方法。 3. 教学重点难点: 重点:缓冲溶液 pH 的计算,缓冲容量的概念和影响因素,缓冲溶液的配置 难点: 缓冲溶液 pH 的计算 4. 教学建议: 使用多媒体授课。 第五章:化学热力学基础 1. 基本内容: 化学热力学基本概念,化学反应的热效应,化学反应的方向和限度,吉布斯自由能变与化 学平衡常数。 2. 教学基本要求: 了解内能、焓、熵、吉布斯自由能等热力学基本概念,熟悉状态函数的特点。 掌握盖斯定律、标准生成焓、标准燃烧焓、标准燃烧热及有关计算。 掌握利用吉布斯自由能判断化学反应方向和限度的方法。 熟悉化学平衡和标准平衡常数的概念,掌握化学反应等温方程式及其应用。 3. 教学重点难点: 重点:化学热力学基本概念,热力学第一定律,化学反应的热效应,化学反应热的计算, 热力学第二定律,平衡常数及影响因素。 难点: 熵与熵变,吉布斯自由能判据 4. 教学建议: 使用多媒体授课。 第六章:化学动力学基础 1. 基本内容: 化学反应速率及其表示方法,化学反应速率理论简介,浓度对化学反应速率的影响,温度 对化学反应速率的影响,催化剂对化学反应速率的影响。 2. 教学基本要求: 掌握一级反应、二级反应、零级反应和阿累尼乌斯公式的计算及其应用

熟悉化学反应速率及其表示方法、有效碰撞理论和质量作用定律的意义。 了解过波状态理论及催化剂对反应速率的影响。 3.教学重点难点 重点:基元反应和复杂反应,质量作用定律,碰撞理论,具有简单级数的反应(一级反应 二级反应、零级反应),阿累尼乌斯公式的计算及其应用,催化剂对化学反应速率的影响。 难点:化学反应速率理论,温度对化学反应速率的影响。 4.教学建议: 使用多媒体授课。 第七章:氧化还原与电极电势 1.基本内容: 氧化还原反应的基本概念,原电池与电极电势,影响电极电势的因素,电极电势和电池电 动势的应用,元素电势图。 2.教学基本要求: 了解氧化还原反应的本质和特征。 熟悉电极电势产生的原因和影响电极电势的因素。 掌握电极电势及电池电动势的应用和元素电势图的应用。 3.教学重点难点: 重点:氧化还原反应的本质和特征,原电池的组成及其表示,电极的类型及电极反应的书 写,电极电势与吉布斯自由能变的关系,能斯特方程,影响电极电势的因素及其有关计算,判 断氧化还原反应进行的方向及进行的程度,元素电势图及其应用。 难点:原电池的组成及其表示,能斯特方程及其应用,影响电极电势的因素及其有关计算。 判断氧化还原反应进行的方向及进行的程度。 4.教学建议: 使用多媒体授课。 第八章:原子结构与元素周期表 1.基本内容 电子运动状态的量子力学概念,氢原子的波函数,多电子原子的核外电子排布,原子的电 子组态与元素周期表。 2。教学基本要求: 掌挥量子数的取值和组合及其与原子轨道的关系、电子的运动状态、多电子原子能级、核 外电子组态。 熟悉波粒二象性、不确定原理、波函数、概率密度、电子云、原子轨道的角度分布图、径 向分布函数图、电负性。 了解元素周期表的分区、元素性质的周期性。 21
21 熟悉化学反应速率及其表示方法、有效碰撞理论和质量作用定律的意义。 了解过渡状态理论及催化剂对反应速率的影响。 3. 教学重点难点: 重点:基元反应和复杂反应,质量作用定律,碰撞理论,具有简单级数的反应(一级反应、 二级反应、零级反应),阿累尼乌斯公式的计算及其应用,催化剂对化学反应速率的影响。 难点: 化学反应速率理论,温度对化学反应速率的影响。 4. 教学建议: 使用多媒体授课。 第七章:氧化还原与电极电势 1. 基本内容: 氧化还原反应的基本概念,原电池与电极电势,影响电极电势的因素,电极电势和电池电 动势的应用,元素电势图。 2. 教学基本要求: 了解氧化还原反应的本质和特征。 熟悉电极电势产生的原因和影响电极电势的因素。 掌握电极电势及电池电动势的应用和元素电势图的应用。 3. 教学重点难点: 重点:氧化还原反应的本质和特征,原电池的组成及其表示,电极的类型及电极反应的书 写,电极电势与吉布斯自由能变的关系,能斯特方程,影响电极电势的因素及其有关计算,判 断氧化还原反应进行的方向及进行的程度,元素电势图及其应用。 难点: 原电池的组成及其表示,能斯特方程及其应用,影响电极电势的因素及其有关计算, 判断氧化还原反应进行的方向及进行的程度。 4. 教学建议: 使用多媒体授课。 第八章:原子结构与元素周期表 1. 基本内容: 电子运动状态的量子力学概念,氢原子的波函数,多电子原子的核外电子排布,原子的电 子组态与元素周期表。 2. 教学基本要求: 掌握量子数的取值和组合及其与原子轨道的关系、电子的运动状态、多电子原子能级、核 外电子组态。 熟悉波粒二象性、不确定原理、波函数、概率密度、电子云、原子轨道的角度分布图、径 向分布函数图、电负性。 了解元素周期表的分区、元素性质的周期性