
例6.1.4Na2C0,(s)与H20(L)可以生成如下三种水化物: Na2CO3 H2O (s)Na2CO3 7H2O(s)Na2CO310 H2O(s) (①)试指出在标准压力下,H,O(s)与Na2CO3的水溶液平衡 共存的水化物最多能有几种? (i)试指出在30℃时,与H20(g)平衡共存的Na2C03的水化 物最多能有几种? 解: C=5-3-0=2 F’=C-P+1=0 P=C+1=2十1=3 (1)除了H20(s)和Na2CO,的水溶液外,还有1种 (2)除了H20(g)外,还有2种
例6.1.4 Na2CO3(s)与H2O (l)可以生成如下三种水化物: Na2CO3⋅ H2O (s)、Na2CO3⋅ 7H2O (s )和Na2CO3⋅10 H2O (s) (i)试指出在标准压力下, H2O (s)与Na2CO3的水溶液平衡 共存的水化物最多能有几种? (ii)试指出在30℃时,与H2O (g)平衡共存的Na2CO3的水化 物最多能有几种? 解: C = 5 -3 -0 =2 F’ = C- P+1 =0 P = C + 1 = 2 + 1 = 3 (1) 除了H2O (s)和Na2CO3的水溶液外,还有1种 (2)除了H2O (g)外,还有2种

6.2单组分系统相图 6.2.1单组分系统的相数与自由度 F=C-P十2=3-P 当P=1时,F=2, 双变量系统; 当P=2时,F=1, 单变量系统: 当P=3时,F=0, 无变量系统。 单组分系统的自由度最多为2,双变量系统 的相图可用平面图表示
6.2 单组分系统相图 6.2.1 单组分系统的相数与自由度 F = C-P +2 = 3- P 当P=1时, F =2, 双变量系统; 当P=2时, F =1, 单变量系统; 当P=3时, F =0, 无变量系统。 单组分系统的自由度最多为2,双变量系统 的相图可用平面图表示
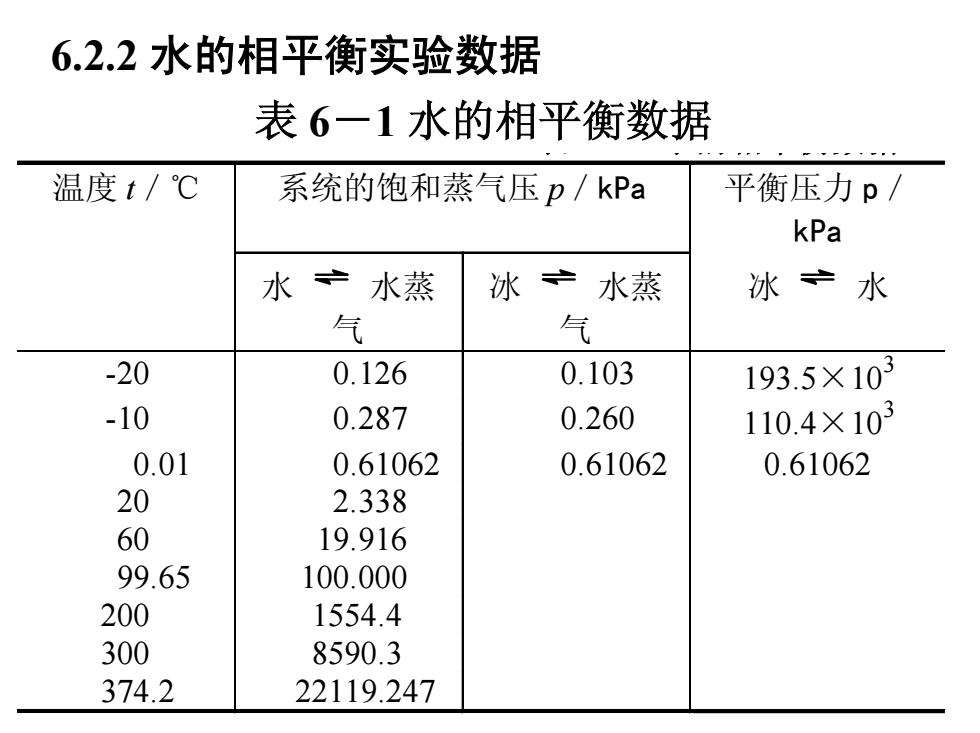
6.2.2水的相平衡实验数据 表6一1水的相平衡数据 温度t/℃ 系统的饱和蒸气压p/kPa 平衡压力p/ kPa 水产水蒸 冰 宁水蒸 冰宁水 气 气 -20 0.126 0.103 193.5×103 -10 0.287 0.260 110.4×103 0.01 0.61062 0.61062 0.61062 20 2.338 60 19.916 99.65 100.000 200 1554.4 300 8590.3 374.2 22119.247
6.2.2 水的相平衡实验数据 表 水的相平衡数据 温度 t/℃ 系统的饱和蒸气压 p/kPa 平衡压力 p/ kPa 水 水蒸 气 冰 水蒸 气 冰 水 -20 0.126 0.103 193.5×103 -10 0.287 0.260 110.4×103 0.01 0.61062 0.61062 0.61062 20 2.338 60 19.916 99.65 100.000 200 1554.4 300 8590.3 374.2 22119.247 表 6-1 水的相平衡数据
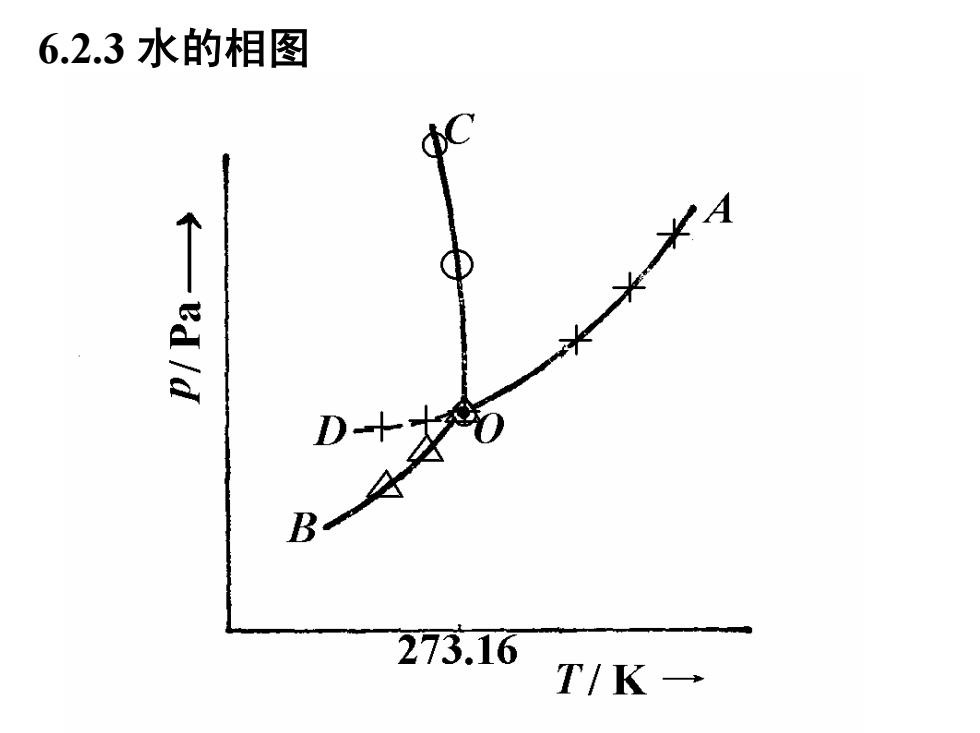
6.2.3水的相图 ed/d 273.16 T/K→
6.2.3 水的相图
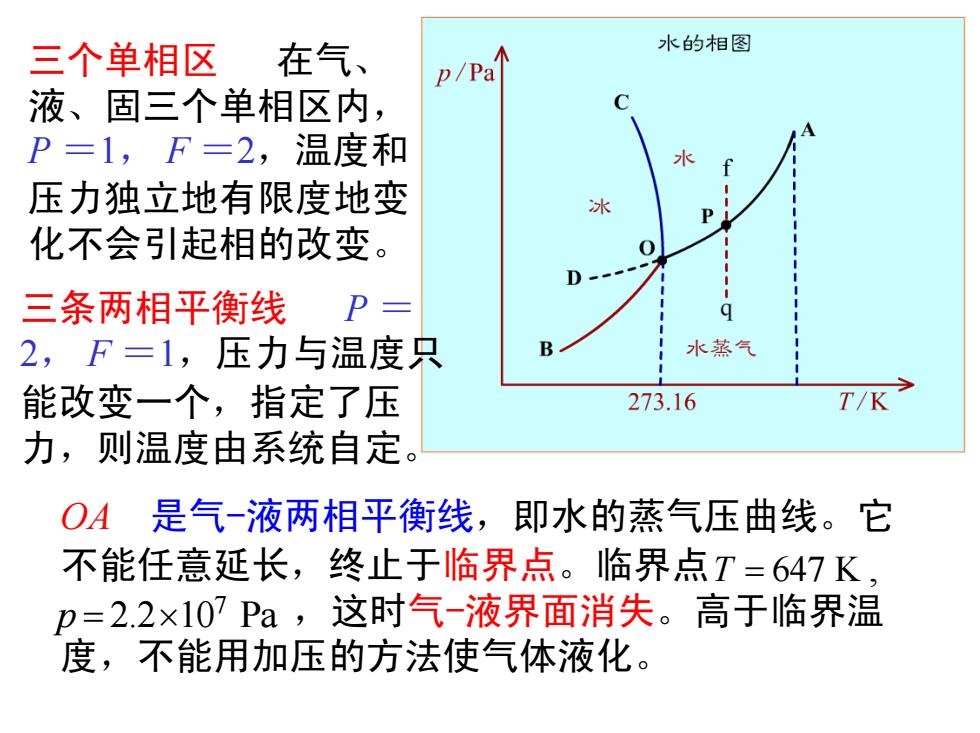
三个单相区 在气、 水的相图 p/Pa 液、固三个单相区内, P=1,F=2,温度和 水 压力独立地有限度地变 冰 P 化不会引起相的改变。 0 三条两相平衡线P= 2,F=1,压力与温度只 水蒸气 能改变一个,指定了压 273.16 T/K 力,则温度由系统自定。 OA是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点T=647K, p=2.2×107Pa,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化
三个单相区 在气、 液、固三个单相区内, P =1, F =2,温度和 压力独立地有限度地变 化不会引起相的改变。 三条两相平衡线 P = 2, F =1,压力与温度只 能改变一个,指定了压 力,则温度由系统自定。 OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点 ,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化。 T = 647 K , 7 p = 2.2×10 Pa