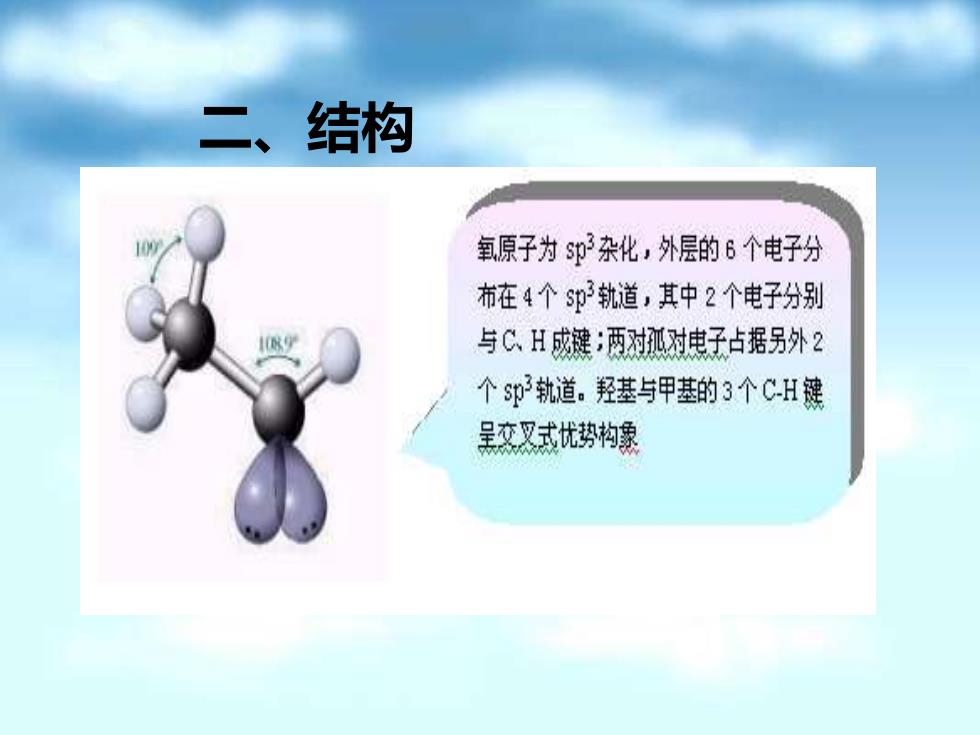
二、结构 氧原子为$p杂化,外层的6个电子分 布在4个$p轨道,其中2个电子分别 与C、H成键:两对孤对电子占据另外2 个sp轨道。羟基与甲基的3个CH键 黑交叉式忧势构象
二、结构
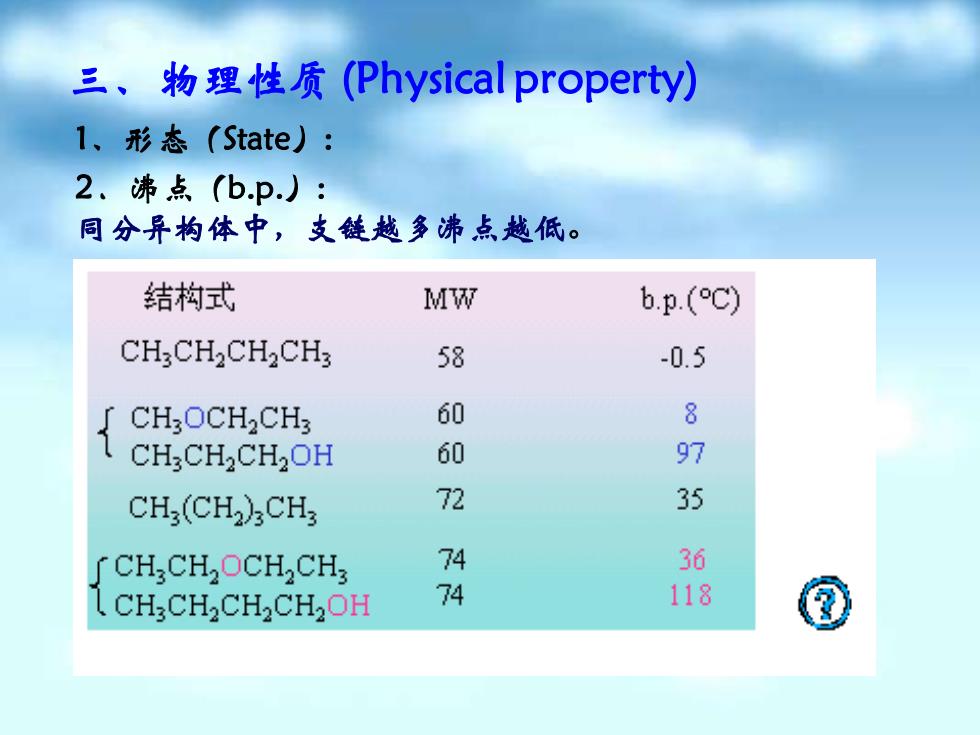
三、物理性质(Physical property). l、形态(State).: 2、沸点(bp): 同分异构体中,支链越多沸点越低。 结构式 MW b.p.(C) CH.CH2CH2CH: 58 -0.5 { CHOCHCH 60 8 CH2CH2CH2OH 60 97 CH(CH2)CH 72 35 CH CHOCH,CH 74 36 CHCH2CH2CH2OH 74 118
三、物理性质(Physical property) 1、形态(State): 2.沸点(b.p.): 同分异构体中,支链越多沸点越低
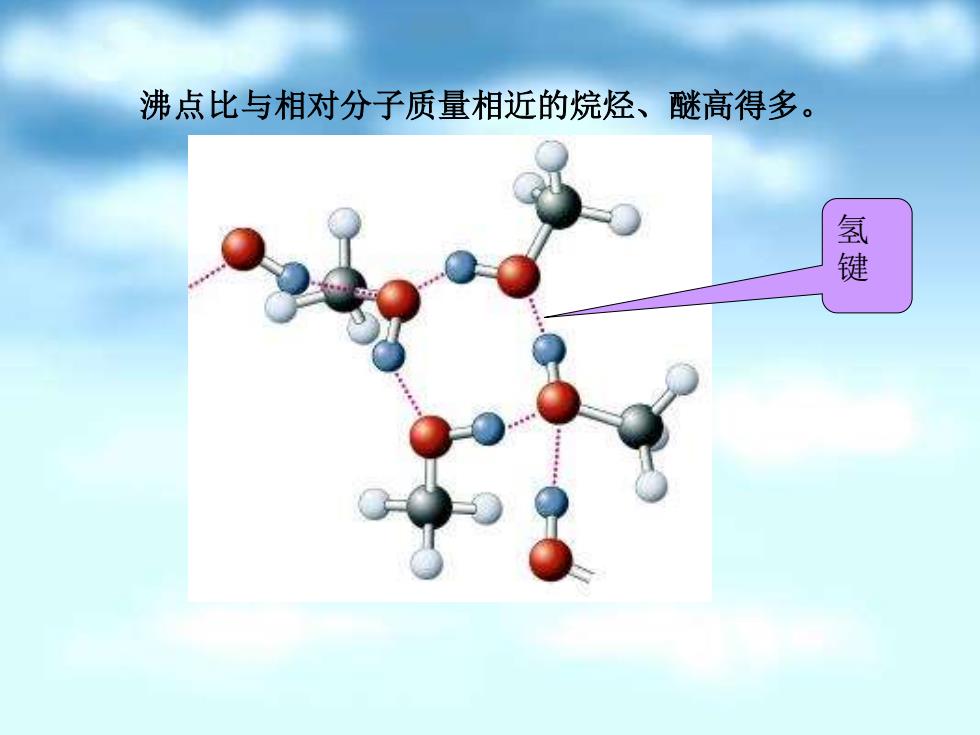
沸点比与相对分子质量相近的烷烃、醚高得多。 氢键
氢 键 沸点比与相对分子质量相近的烷烃、醚高得多

原因:这是因为液态醇羟基之间可通过氢键使分子缔合, 而烷烃就不存在这种分子间的氢键。 3.溶解度(Solubility): 氢键对其水中的溶解度有显著的影响。 低级醇或多元醇因烃基较小,羟基与水之间形成氢键的 吸引力占主导地位,与水互溶。碳原子数增多时,烃基 也增大,不利于形成氢键,溶解度下降
原因:这是因为液态醇羟基之间可通过氢键使分子缔合, 而烷烃就不存在这种分子间的氢键。 3. 溶解度(Solubility): 氢键对其水中的溶解度有显著的影响。 低级醇或多元醇因烃基较小,羟基与水之间形成氢键的 吸引力占主导地位,与水互溶。碳原子数增多时,烃基 也增大,不利于形成氢键,溶解度下降
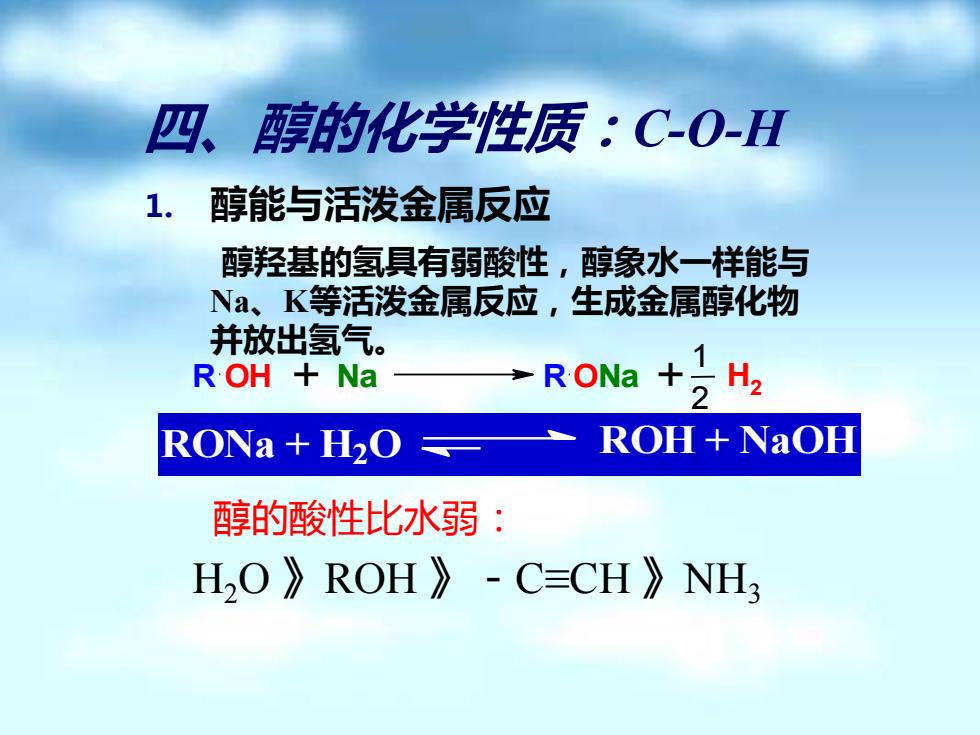
四、醇的化学性质.C-O-H 1.醇能与活泼金属反应 醇羟基的氢具有弱酸性,醇象水一样能与 Na、K等活泼金属反应,生成金属醇化物 并放出氢气。 R OH Na R ONa 2风 RONa +H2O ROH+NaOH 醇的酸性比水弱: HO》ROH》-C=CH》NH3
四、醇的化学性质:C-O-H 1. 醇能与活泼金属反应 醇羟基的氢具有弱酸性,醇象水一样能与 Na、K等活泼金属反应,生成金属醇化物 并放出氢气。 RONa + H2 O ROH + NaOH R OH + Na R ONa + H2 1 2 醇的酸性比水弱: H2O 》ROH 》-C≡CH 》NH3