
第二章链烃知识要点:一、结构特点烷烃:分之中的碳除以碳碳单键相连外,碳的其他价键都为氢原子所饱和的烃叫做烷烃也叫做饱和烃。1)烷烃的分子组成通式:CnH2n+2。2)碳原子都是以SP杂化轨道与其他原子形成α键,碳原子都为正四面体结构。3)C-C键长均为0.154nm,C-H键长为0.109nm,,键角都接近于109.5°。碳原子和氢原子的分类伯碳:又称第一碳,用1℃表示一一与一个C原子直接相连。仲碳:又称第二碳,用2℃表示一一与二个C原子直接相连。叔碳:又称第三碳,用3℃表示一一与三个C原子直接相连。季碳:又称第四碳,用4℃表示一一与四个C原子直接相连。1)碳原子都是以SP杂化轨道与其他原子形成α键,碳原子都为正四面体结构。2)C-C键长均为0.154nm,C-H键长为0.109nm,,键角都接近于109.5°。3)碳链一般是曲折地排布在空间,在晶体时碳链排列整齐,呈锯齿状,在气、液态时呈多种曲折排列形式(因α键能自由旋转所致)。二、命名烷烃常用的命名法有普通命名法和系统命名法(一)普通命名法根据分子中碳原子数目称为“某烷”,碳原子数十个以内的依次用甲、乙、丙、丁、戊..….癸表示,十以上的用汉字数字表示碳原子数,用正、异、新表示同分异构体。(二)系统命名法烷基—烷烃分之中去掉一个氢原子而剩下的原子团称为烷基。烷基名称通常符号MeCHs-甲基乙基EtCH,CH,-丙基CH.CHCH--n-Pr异丙基i-PrCH,CH-CHs7
7 • • 第二章 链烃 知识要点: 一、结构特点 烷烃:分之中的碳除以碳碳单键相连外,碳的其他价键都为氢原子所饱和的烃叫做烷烃, 也叫做饱和烃。 1)烷烃的分子组成通式:CnH2n+2 。 2)碳原子都是以 SP3 杂化轨道与其他原子形成σ键,碳原子都为正四面体结构。 3)C-C 键长均为 0.154nm, C-H 键长为 0.109nm,键角都接近于 109.5°。 碳原子和氢原子的分类 伯碳:又称第一碳,用 1℃表示——与一个 C 原子直接相连。 仲碳:又称第二碳,用 2℃表示——与二个 C 原子直接相连。 叔碳:又称第三碳,用 3℃表示——与三个 C 原子直接相连。 季碳:又称第四碳,用 4℃表示——与四个 C 原子直接相连。 1) 碳原子都是以 SP3 杂化轨道与其他原子形成σ键,碳原子都为正四面体结构。 2) C-C 键长均为 0.154nm, C-H 键长为 0.109nm,键角都接近于 109.5°。 3) 碳链一般是曲折地排布在空间,在晶体时碳链排列整齐,呈锯齿状,在气、液态 时呈多种曲折排列形式(因σ键能自由旋转所致)。 二、命名 烷烃常用的命名法有普通命名法和系统命名法 (一)普通命名法 根据分子中碳原子数目称为“某烷”,碳原子数十个以内的依次用甲、乙、丙、丁、戊. 癸表示,十以上的用汉字数字表示碳原子数,用正、异、新表示同分异构体。 (二)系统命名法 烷基 烷烃分之中去掉一个氢原子而剩下的原子团称为烷基。 烷基 名称 通常符号 CH3- 甲基 Me CH3CH2- 乙基 Et CH3CH2CH2- 丙基 n-Pr CH3CH- 异丙基 i-Pr CH3

CHCHCHCH-正丁基n-Bu异丁基i-BuCH,CHCHCHsCH.CH,CH-仲丁基s-BuCHsCH3CH_c -叔丁基t-BuCHs烷基的通式为CnH2n+1常用R表示命名:1.选择主连(母体)(1)选择含碳原子数目最多的碳链作为主链,支链作为取代基。(2)分之中有两条以上等长碳链时,则选择支链多的一条为主链。2.碳原子的编号(1)从最接近取代基的一端开始,将主链碳原子用1、2、3….·编号(2)从碳链任何一端开始,第一个支链的位置都相同时,则从较简单的一端开始编号。(3)若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系列编号最小(最低系列原则)为原则。3.烷烃名称的写出A将支链(取代基)写在主链名称的前面B取代基按“次序规则”小的基团优先列出烷基的大小次序:甲基<乙基<丙基<丁基<戊基<已基<异戊基<异丁基<异丙基。C相同基团合并写出,位置用2,3标出,取代基数目用二,三...标出。D表示位置的数字间要用逗号隔开,位次和取代基名称之间要用“半字线”隔开。可将烷烃的命名归纳为十六个字:最长碳链,最小定位,同基合并,由简到繁。三、构象构象一一构造一定的分子,通过单键的旋转而引起的分之中各原子在空间的不同排布称为构象。乙烷的构象8
• • 8 CH3CH2CH2CH2- 正丁基 n-Bu CH3CHCH2- 异丁基 i-Bu CH3 CH3CH2CH- 仲丁基 s-Bu CH3 CH3 CH3 C 叔丁基 t-Bu CH3 烷基的通式为 CnH2n+1 常用 R 表示 命名: 1.选择主连(母体) (1) 选择含碳原子数目最多的碳链作为主链,支链作为取代基。 (2) 分之中有两条以上等长碳链时,则选择支链多的一条为主链。 2.碳原子的编号 (1) 从最接近取代基的一端开始,将主链碳原子用 1、2、3.编号 (2)从碳链任何一端开始,第一个支链的位置都相同时,则从较简单的一端开始编号。 (3) 若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系 列编号最小(最低系列原则)为原则。 3.烷烃名称的写出 A 将支链(取代基)写在主链名称的前面 B 取代基按“次序规则”小的基团优先列出 烷基的大小次序:甲基<乙基<丙基<丁基<戊基<己基<异戊基<异丁基<异丙基。 C 相同基团合并写出,位置用 2,3.标出, 取代基数目用二,三.标出。 D 表示位置的数字间要用逗号隔开,位次和取代基名称之间要用“半字线”隔开。 可将烷烃的命名归纳为十六个字:最长碳链,最小定位,同基合并,由简到繁。 三、构象 构象——构造一定的分子,通过单键的旋转而引起的分之中各原子在空间的不同排布 称为构象。 乙烷的构象
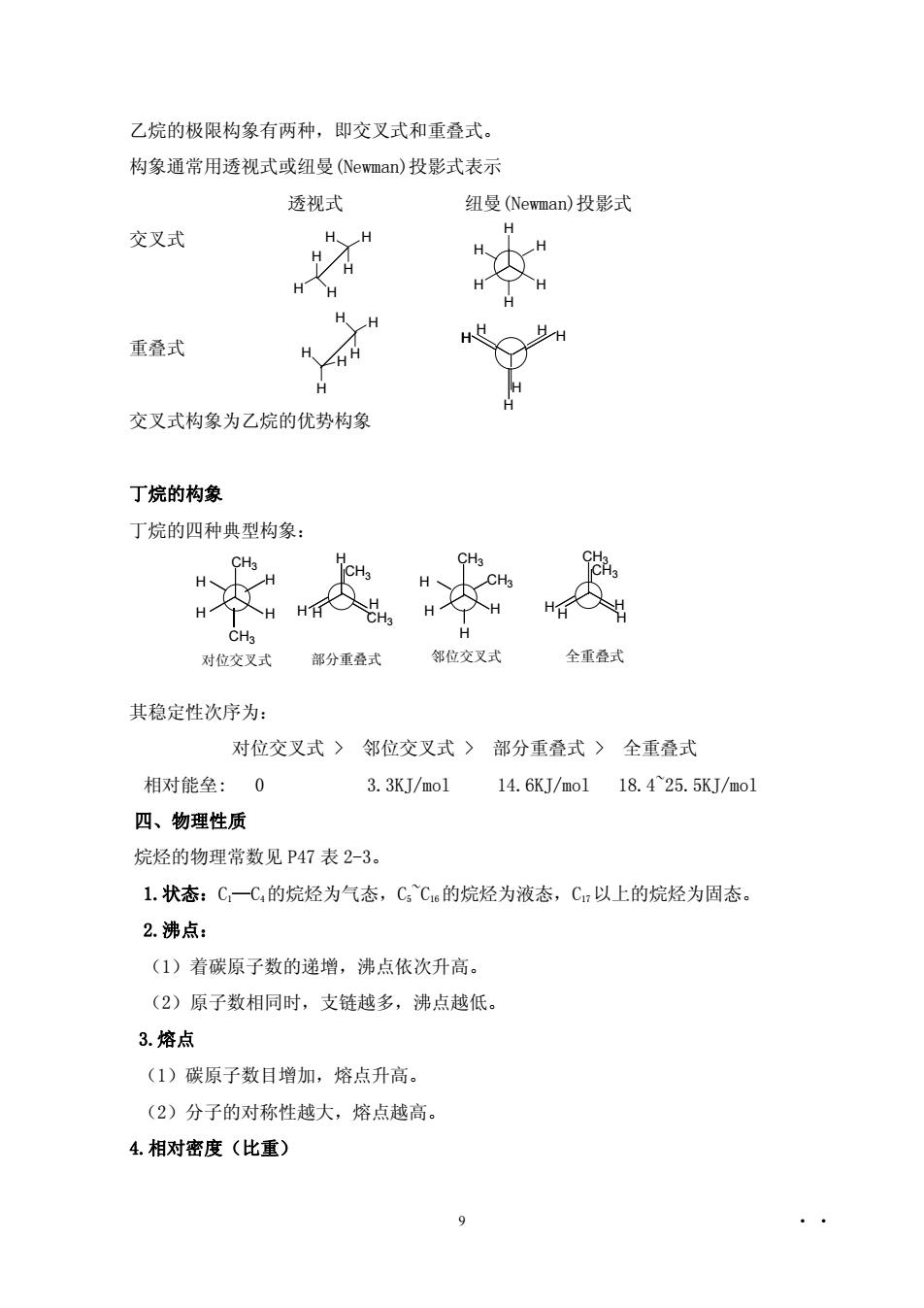
乙烷的极限构象有两种,即交又式和重叠式。构象通常用透视式或纽曼(Newman)投影式表示透视式纽曼(Newman)投影式HHH交叉式HHXHIHHHAX重叠式H、ZHHHHH交叉式构象为乙烷的优势构象丁烷的构象丁烷的四种典型构象:CH3CH3lCH3HCH3H-H人HHHHHHHCH3HCH3全重叠式邻位交叉式部分重叠式对位交叉式其稳定性次序为:对位交叉式》邻位交叉式部分重叠式全重叠式相对能垒:03.3KJ/mol14.6KJ/mo118.4~25.5KJ/mol四、物理性质烷烃的物理常数见P47表2-3。1.状态:C一C的烷烃为气态,C,Cl6的烷烃为液态,C以上的烷烃为固态。2.沸点:(1)着碳原子数的递增,沸点依次升高。(2)原子数相同时,支链越多,沸点越低。3.熔点(1)碳原子数目增加,熔点升高。(2)分子的对称性越大,熔点越高。4.相对密度(比重)9
9 • • 乙烷的极限构象有两种,即交叉式和重叠式。 构象通常用透视式或纽曼(Newman)投影式表示 透视式 纽曼(Newman)投影式 交叉式 重叠式 交叉式构象为乙烷的优势构象 丁烷的构象 丁烷的四种典型构象: 其稳定性次序为: 对位交叉式 > 邻位交叉式 > 部分重叠式 > 全重叠式 相对能垒: 0 3.3KJ/mol 14.6KJ/mol 18.4~25.5KJ/mol 四、物理性质 烷烃的物理常数见 P47 表 2-3。 1.状态:C1—C4的烷烃为气态,C5~C16的烷烃为液态,C17以上的烷烃为固态。 2.沸点: (1)着碳原子数的递增,沸点依次升高。 (2)原子数相同时,支链越多,沸点越低。 3.熔点 (1)碳原子数目增加,熔点升高。 (2)分子的对称性越大,熔点越高。 4.相对密度(比重) H H H H H H H H H H H H H H H H H H H H H H H H CH3 H CH3 CH3 CH3 CH3 CH3 CH3 CH3 H H H H H H H H H H H H H H H 对位交叉式 部分重叠式 邻位交叉式 全重叠式

都小于1,随着分子量的增加而增加,最后接近于0.8(20℃)。分子间的引力增大分子间的距离相应减小,相对密度就增大。5.溶解度不溶与水,溶于某些有机溶剂,尤其是烃类中(“相似相溶”原理)。五、化学性质(一)氧化和燃烧烷烃在空气中燃烧,生成二氧化碳和水,并放出大量的热能。如:3n+1燃烧CnH2n+2 +O.nCO2 + (n+1)H2O +热能(Q)2A92 02CH14+++6CO2+7H2O+4138KJ/mol(二)热裂反应在高温及没有氧气的条件下使烷烃分子中的C-C键和C-H键发生断裂的反应称为热裂反应。(三)卤代反应烷烃的氢原子被卤素取代生成卤代烃的反应称为卤代反应。通常是指氯代或溴代。1.甲烷的氯代反应黑暗中不发生反应CH4 + Cl2强烈日光4HCI + C猛烈反应在紫外光漫射或高温下,甲烷易与氯、溴发生反应。CH4 + Ch 漫射光、CHa-CI + HCI甲烷的卤代反应较难停留在一元阶段,氯甲烷还会继续发生氯化反应,生成二氯甲烷、三氯甲烷和四氯化碳。2.其他烷烃的氯代反应伯、仲、叔氢的相对反应活性为:氯代:3°H:2°H:1°H=5:4:1溴代:3°H:2°H:1°H=1600:82:1(四)烷烃的卤代反应机理1.甲烷的氯代历程10
• • 10 都小于 1,随着分子量的增加而增加,最后接近于 0.8(20℃)。分子间的引力增大, 分子间的距离相应减小,相对密度就增大。 5.溶解度 不溶与水,溶于某些有机溶剂,尤其是烃类中(“相似相溶”原理)。 五、化学性质 (一)氧化和燃烧 烷烃在空气中燃烧,生成二氧化碳和水,并放出大量的热能。如: (二)热裂反应 在高温及没有氧气的条件下使烷烃分子中的 C-C 键和 C-H 键发生断裂的反应称为热 裂反应。 (三)卤代反应 烷烃的氢原子被卤素取代生成卤代烃的反应称为卤代反应。通常是指氯代或溴代。 1.甲烷的氯代反应 在紫外光漫射或高温下,甲烷易与氯、溴发生反应。 甲烷的卤代反应较难停留在一元阶段,氯甲烷还会继续发生氯化反应,生成二氯 甲烷、三氯甲烷和四氯化碳。 2.其他烷烃的氯代反应 伯、仲、叔氢的相对反应活性为: 氯代:3°H :2°H :1°H = 5 :4 :1 溴代:3°H :2°H :1°H = 1600 :82 :1 (四)烷烃的卤代反应机理 1.甲烷的氯代历程 CnH2n+2 3n+1 2 O2 燃烧 nCO2 + (n+1)H2O + 热能(Q) C6H14 + 9 O2 6CO2 + 7H2O + 4138KJ/mol 1 2 CH4 Cl2 黑暗中 强烈日光 不发生反应 4HCl + C 猛烈反应 CH4 Cl2 CH3 Cl HCl 漫射光

实验证明,甲烷的氯代反应为自由基历程huor CI: CI2 CI.链引发CH4 + CI.CH3+HCICH3. + Ch2CH3-CI + CI.CHs-CI + CI.CH2-CI + HCI链增长阶段CH2-Cl2 + CI. CH2-CI + Cl2CI. + CI.Cl2CH3. + CH3CH3-CH3链终止阶段. CH3 + CI.CHs-CI从上可以看出,一且有自由基生成,反应就能连续的进行下去,这样周而复始,反复不断的进行反应,故又称为链锁反应。凡是自由基反应,都是经过链的引发、链的传递、链的终止三个阶段来完成的。2. 卤素的相对反应活性卤素的反应活性:氟>氯>溴>碘。P3940可从卤素对甲烷的反应热△H看出,见P62表2-183.烷烃卤代反应的相对活性与烷基自由基的稳定性(1)烷烃卤代的相对活性:3°C-H>2°C-H>1°C-H原因:不同C-H键的离解能(D)不同,见P41,键的离解能愈小,则自游基愈容易生成,反应也就易进行。(2)自由基的稳定性:3°R.>2°R.>1°R.>CH:原因:同上,即愈容易生成的自由基愈稳定。$2—2烯烃烯烃的结构(一)双键的结构1.双键碳原子为sp2杂化2.双键由α键和元键组成(二)α键和元键的比较1.α键可以单独存在,并存在于任何含共价键的分子中。11
11 • • 实验证明,甲烷的氯代反应为自由基历程 从上可以看出,一旦有自由基生成,反应就能连续的进行下去,这样周而复始,反复 不断的进行反应,故又称为链锁反应。 凡是自由基反应,都是经过链的引发、链的传递、链的终止三个阶段来完成的。 2.卤素的相对反应活性 卤素的反应活性: 氟 > 氯 > 溴 > 碘。P39~40 可从卤素对甲烷的反应热ΔHR看出,见 P62 表 2-18 3.烷烃卤代反应的相对活性与烷基自由基的稳定性 (1)烷烃卤代的相对活性: 3°C-H > 2°C-H > 1°C-H 原因:不同 C-H 键的离解能(D)不同, 见 P41,键的离解能愈小,则自游基愈容 易生成,反应也就易进行。 (2)自由基的稳定性: 3°R· > 2°R· > 1°R· > CH3· 原因: 同上,即愈容易生成的自由基愈稳定。 §2—2 烯 烃 一、 烯烃的结构 (一)双键的结构 1.双键碳原子为 sp2 杂化 2.双键由σ键和π键组成 (二)σ键和π键的比较 1. σ键可以单独存在,并存在于任何含共价键的分子中。 Cl Cl h or υ 2 Cl CH4 Cl CH3 HCl Cl2 CH3-Cl Cl CH3-Cl Cl CH2-Cl HCl CH2-Cl Cl2 CH2-Cl2 Cl · · · . . 链引发 链增长阶段 Cl · Cl · Cl2 Cl CH3-Cl CH3-CH3 链终止阶段 · · · · · · CH3· CH3· · · CH3 · · CH3