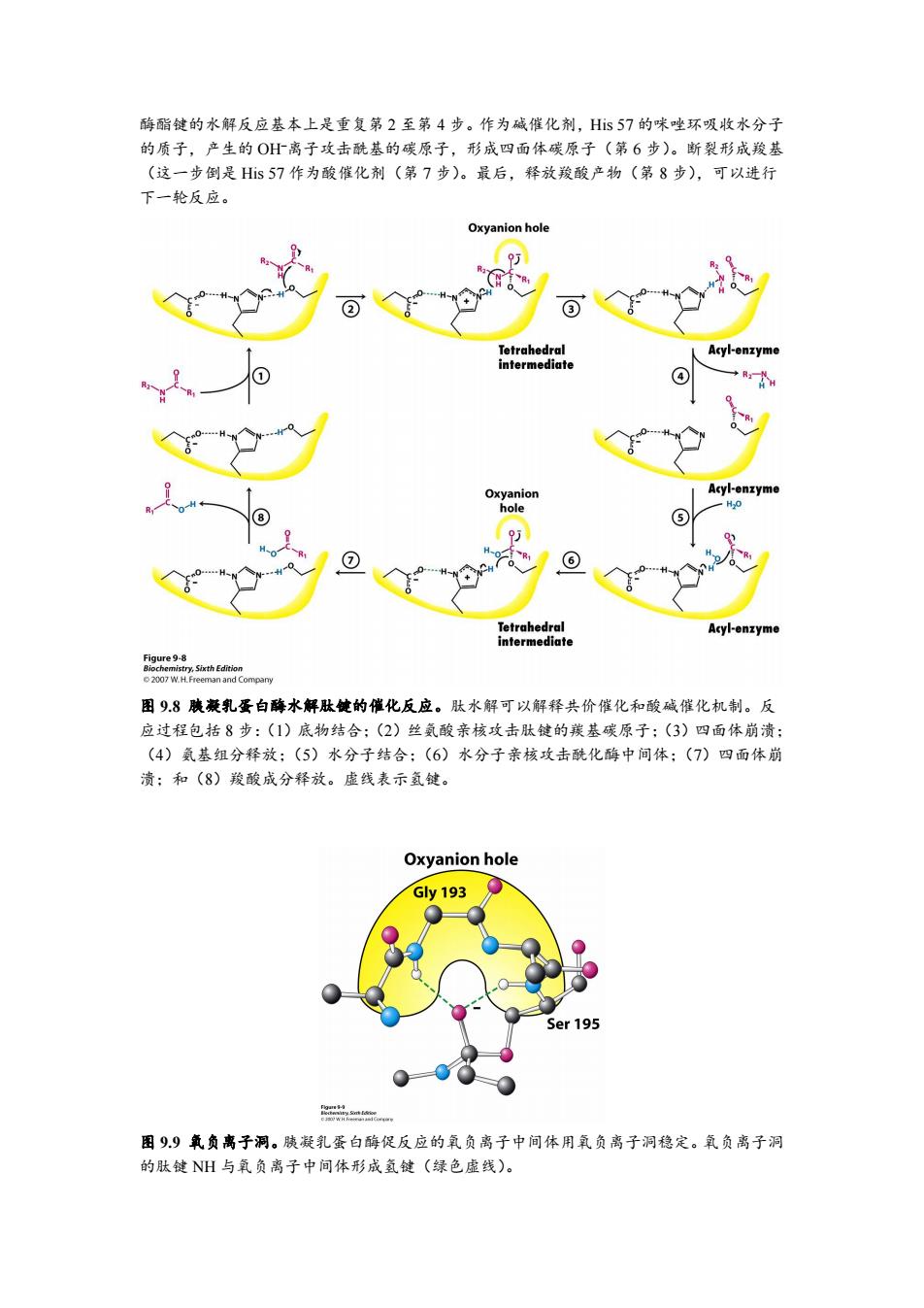
酶酯键的水解反应基本上是重复第2至第4步。作为碱催化剂,Hs57的咪唑环吸收水分子 的质子,产生的OH离子攻击酰基的碳原子,形成四面体碳原子(第6步)。断裂形成羧基 (这一步倒是Hs57作为酸催化剂(第7步)。最后,释放羧酸产物(第8步),可以进行 下一轮反应。 Oxyanion hole ② ③ Tetrahedral Acyl-enzyme intermediate Oxyanion Acyl-enzyme hole 5 ⑦ 6) Tetrahedral Acyl-enzyme intermediate Pigure 图98胰兼乳蛋白酶水解肽健的催化反应。肽水解可以解释共价催化和酸碱催化机制。反 应过程包括8步:(1)底物结合:(2)丝氨酸亲核攻击肽键的羰基碳原子:(3)四面体崩溃: (4)氨基组分释放:(5)水分子结合:(6)水分子亲核攻击酰化酶中间体:(7)四面体崩 溃:和(8)羧酸成分释放。虚线表示氢键。 Oxyanion hole Gy193 Ser 195 图99氧负离子洞。胰凝乳蛋白酶促反应的氧负离子中间体用氧负离子洞稳定。氧负离子洞 的肽键NH与氧负离子中间体形成氢键(绿色虚线)
酶酯键的水解反应基本上是重复第 2 至第 4 步。作为碱催化剂,His 57 的咪唑环吸收水分子 的质子,产生的 OH离子攻击酰基的碳原子,形成四面体碳原子(第 6 步)。断裂形成羧基 (这一步倒是 His 57 作为酸催化剂(第 7 步)。最后,释放羧酸产物(第 8 步),可以进行 下一轮反应。 图 9.8 胰凝乳蛋白酶水解肽键的催化反应。肽水解可以解释共价催化和酸碱催化机制。反 应过程包括 8 步:(1)底物结合;(2)丝氨酸亲核攻击肽键的羰基碳原子;(3)四面体崩溃; (4)氨基组分释放;(5)水分子结合;(6)水分子亲核攻击酰化酶中间体;(7)四面体崩 溃;和(8)羧酸成分释放。虚线表示氢键。 图 9.9 氧负离子洞。胰凝乳蛋白酶促反应的氧负离子中间体用氧负离子洞稳定。氧负离子洞 的肽键 NH 与氧负离子中间体形成氢键(绿色虚线)
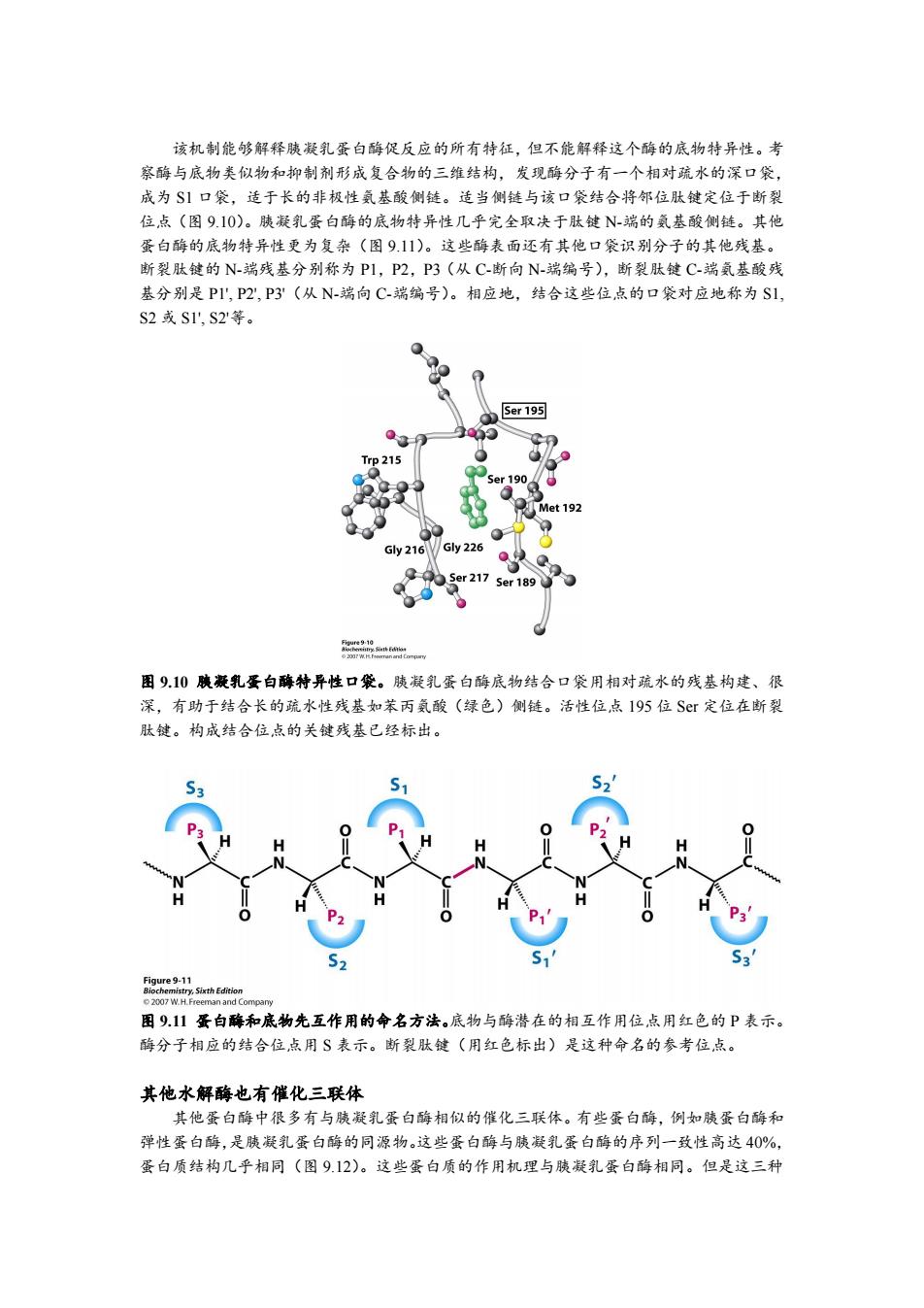
该机制能够解释胰凝乳蛋白酶促反应的所有特征,但不能解释这个酶的底物特异性。考 察酶与底物类似物和抑制剂形成复合物的三维结构,发现酶分子有一个相对疏水的深口袋, 成为S1口袋,适于长的非极性氨基酸侧链。适当侧链与该口袋结合将邻位肽键定位于断裂 位点(图9.10)。胰凝乳蛋白酶的底物特异性几乎完全取决于肽键N-端的氨基酸侧链。其他 蛋白酶的底物特异性更为复杂(图9.11)。这些酶表面还有其他口袋识别分子的其他残基。 断裂肽键的N-端残基分别称为P1,P2,P3(从C-断向N-端编号),断裂肽C-端氨基酸残 基分别是P1',P2,P3'(从N-端向C-端编号)。相应地,结合这些位点的口袋对应地称为S1, S2或S1',S2等。 0 Ser 195 ●3 Trp215 Ser 190 Q Met 192 Gy216 Gly 226 Ser 217 Ser 189 图9.10胰凝乳蛋白酶特异性口袋。胰凝乳蛋白酶底物结合口袋用相对疏水的残基构建、很 深,有助于结合长的疏水性残基如苯丙氨酸(绿色)侧链。活性位,点I95位Sr定位在断裂 肽键。构成结合位点的关键残基已经标出。 0 H ● 51 2007 W.H.Freeman and Company 图911蛋白酶和底物先互作用的命名方法。底物与酶潜在的相互作用位点用红色的P表示。 酶分子相应的结合位,点用S表示。断裂肽键(用红色标出)是这种命名的参考位点。 其他水解酶也有催化三联体 其他蛋白酶中很多有与胰凝乳蛋白酶相似的催化三联体。有些蛋白酶,例如胰蛋白酶和 弹性蛋白酶,是胰凝乳蛋白酶的同源物。这些蛋白酶与胰凝乳蛋白酶的序列一致性高达40%, 蛋白质结构几乎相同(图9.12)。这些蛋白质的作用机理与胰凝乳蛋白酶相同。但是这三种
该机制能够解释胰凝乳蛋白酶促反应的所有特征,但不能解释这个酶的底物特异性。考 察酶与底物类似物和抑制剂形成复合物的三维结构,发现酶分子有一个相对疏水的深口袋, 成为 S1 口袋,适于长的非极性氨基酸侧链。适当侧链与该口袋结合将邻位肽键定位于断裂 位点(图 9.10)。胰凝乳蛋白酶的底物特异性几乎完全取决于肽键 N-端的氨基酸侧链。其他 蛋白酶的底物特异性更为复杂(图 9.11)。这些酶表面还有其他口袋识别分子的其他残基。 断裂肽键的 N-端残基分别称为 P1,P2,P3(从 C-断向 N-端编号),断裂肽键 C-端氨基酸残 基分别是 P1', P2', P3'(从 N-端向 C-端编号)。相应地,结合这些位点的口袋对应地称为 S1, S2 或 S1', S2'等。 图 9.10 胰凝乳蛋白酶特异性口袋。胰凝乳蛋白酶底物结合口袋用相对疏水的残基构建、很 深,有助于结合长的疏水性残基如苯丙氨酸(绿色)侧链。活性位点 195 位 Ser 定位在断裂 肽键。构成结合位点的关键残基已经标出。 图 9.11 蛋白酶和底物先互作用的命名方法。底物与酶潜在的相互作用位点用红色的 P 表示。 酶分子相应的结合位点用 S 表示。断裂肽键(用红色标出)是这种命名的参考位点。 其他水解酶也有催化三联体 其他蛋白酶中很多有与胰凝乳蛋白酶相似的催化三联体。有些蛋白酶,例如胰蛋白酶和 弹性蛋白酶,是胰凝乳蛋白酶的同源物。这些蛋白酶与胰凝乳蛋白酶的序列一致性高达 40%, 蛋白质结构几乎相同(图 9.12)。这些蛋白质的作用机理与胰凝乳蛋白酶相同。但是这三种

蛋白酶的底物特异性差异很大。胰凝乳蛋白酶断裂芳香氨基酸或很长的疏水性氨基酸C端 肽键,胰蛋白酶断裂长的带正电荷氨基酸(即精氨酸和赖氨酸)C-端肽键,弹性蛋白酶断裂 侧链小的氨基酸(如甘氨酸、丝氨酸)C端肽键。比较它们的S1口袋,发现底物特异性差 异的原因在于S1口袋结构的细小差异。胰蛋白酶的S1口袋大,底部有一个Aspl89酸性氨 基酸,而胰凝乳蛋白酶同样位,点是丝氨酸。天冬氨酸能够吸引,稳定底物分子带正电荷的精 氨酸、赖氨酸残基与酶分子结合。弹性蛋白酶的口袋两边有两个Val,分别是Vall90和Val 216。这两个氨基酸残基的侧链挤占口袋空间,使之只能容纳小侧链的氨基酸残基(图9.13)。 图9.12胰蛋白酶和胰装乳蛋白酶的结构类似性。将胰凝乳蛋白酶(红色)置于胰蛋白酶(蓝 色)之上,显示两者相似度很高。此处仅显示-碳原子骨架。两种蛋白质分子之间-碳原 子误差是1.7A。 Asp 189. Val190 Val 216 Val 216 Val 190 Asp 189 Chymotrypsin Trypsin Elastase 图99胰凝乳蛋白酶、胰蛋白酶、和弹性蛋白酶的S1口袋。有些氨基酸残基在决定这些酶 的特异性方面起关键作用。用颜色标出了这些残基的侧链和活性位点的丝氨酸。 胰凝乳蛋白酶家族的其他成员包括参与血液凝固的蛋白酶(在第10章讨论),以及肿瘤 标记蛋白前列腺特异抗原(PSA)。此外,在细菌、病毒和植物中发现的很多蛋白酶也属于 这一家族。 还有些蛋白酶与胰凝乳蛋白酶不同源,但是也具有非常相似的活性位点。在第6章我们 曾经介绍,同一进化使来源不同的蛋白质有相似的活性位,点。枯草杆菌蛋白酶就是一个非常 明显的例子。枯草杆菌蛋白酶也有催化三联体活性位,点和氧离子洞,但是这个酶的氧离子洞
蛋白酶的底物特异性差异很大。胰凝乳蛋白酶断裂芳香氨基酸或很长的疏水性氨基酸 C 端 肽键,胰蛋白酶断裂长的带正电荷氨基酸(即精氨酸和赖氨酸)C-端肽键,弹性蛋白酶断裂 侧链小的氨基酸(如甘氨酸、丝氨酸)C-端肽键。比较它们的 S1 口袋,发现底物特异性差 异的原因在于 S1 口袋结构的细小差异。胰蛋白酶的 S1 口袋大,底部有一个 Asp189 酸性氨 基酸,而胰凝乳蛋白酶同样位点是丝氨酸。天冬氨酸能够吸引,稳定底物分子带正电荷的精 氨酸、赖氨酸残基与酶分子结合。弹性蛋白酶的口袋两边有两个 Val,分别是 Val 190 和 Val 216。这两个氨基酸残基的侧链挤占口袋空间,使之只能容纳小侧链的氨基酸残基(图 9.13)。 图 9.12 胰蛋白酶和胰凝乳蛋白酶的结构类似性。将胰凝乳蛋白酶(红色)置于胰蛋白酶(蓝 色)之上,显示两者相似度很高。此处仅显示碳原子骨架。两种蛋白质分子之间碳原 子误差是 1.7A。 图 9.9 胰凝乳蛋白酶、胰蛋白酶、和弹性蛋白酶的 S1 口袋。有些氨基酸残基在决定这些酶 的特异性方面起关键作用。用颜色标出了这些残基的侧链和活性位点的丝氨酸。 胰凝乳蛋白酶家族的其他成员包括参与血液凝固的蛋白酶(在第 10 章讨论),以及肿瘤 标记蛋白前列腺特异抗原(PSA)。此外,在细菌、病毒和植物中发现的很多蛋白酶也属于 这一家族。 还有些蛋白酶与胰凝乳蛋白酶不同源,但是也具有非常相似的活性位点。在第 6 章我们 曾经介绍,同一进化使来源不同的蛋白质有相似的活性位点。枯草杆菌蛋白酶就是一个非常 明显的例子。枯草杆菌蛋白酶也有催化三联体活性位点和氧离子洞,但是这个酶的氧离子洞
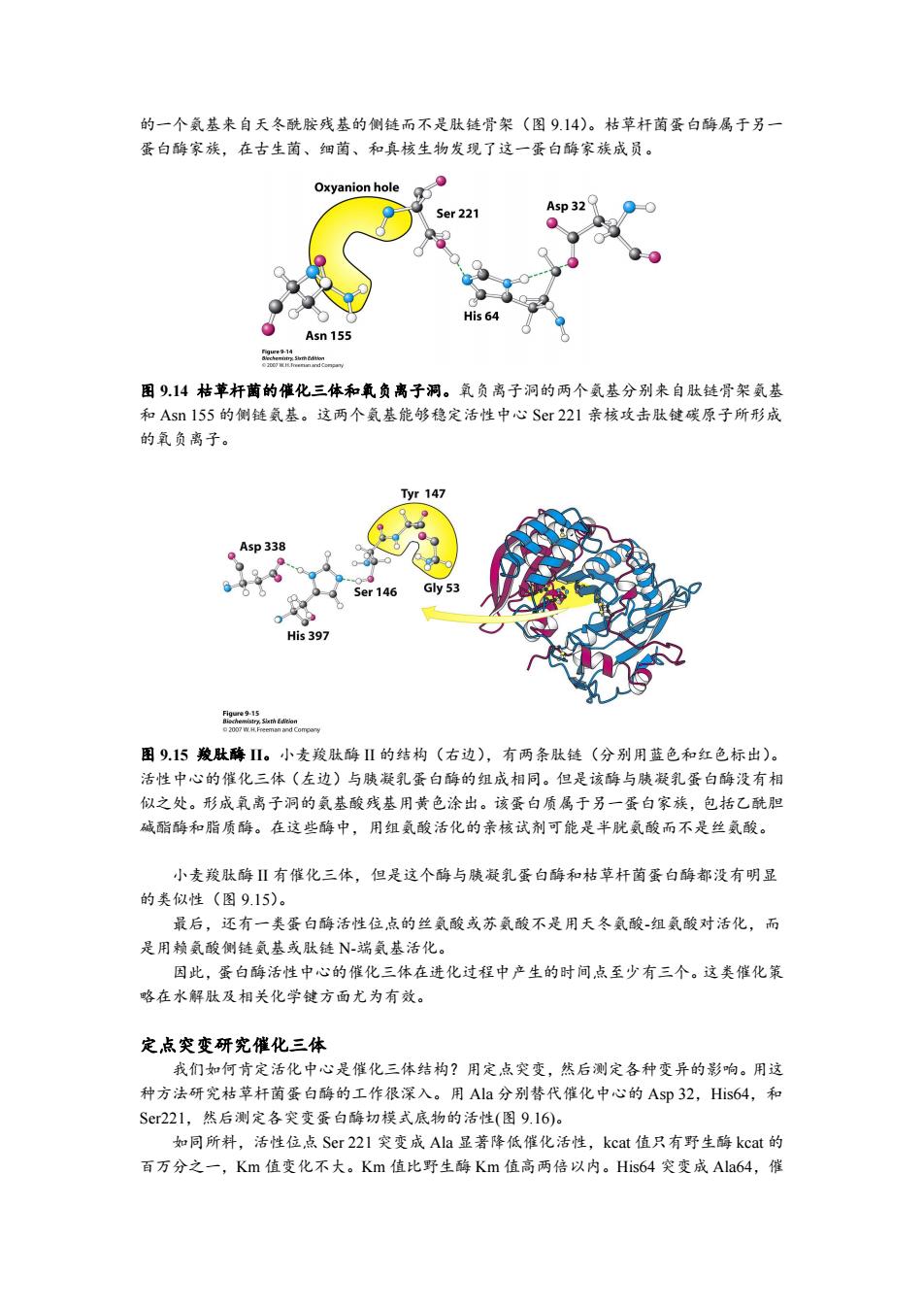
的一个氨基来自天冬酰胺残基的侧链而不是肽链骨架(图9.14)。枯草杆菌蛋白酶属于另一 蛋白酶家族,在古生菌、细菌、和真核生物发现了这一蛋白酶家族成员。 Oxyanion hole Ser 221 Asp 32 His 64 Asn 155 图914枯苹杆菌的催化三体和氧负离子洞。氧负离子洞的两个气基分别来自肽链骨架氨基 和Asn155的侧链氦基。这两个氨基能够稳定活性中心Sr221亲核攻击肽键碳原子所形成 的氧负离子。 yr147 Asp 338 Ser 146 Gly 53 0 His 397 feca5shEon 图9.15羧肽酶Ⅱ。小麦羧肽酶Ⅱ的结构(右边),有两条肽链(分别用蓝色和红色标出)。 活性中心的催化三体(左边)与胰凝乳蛋白酶的组成相同。但是该酶与胰凝乳蛋白酶没有相 似之处。形成氧离子洞的氨基酸残基用黄色涂出。该蛋白质属于另一蛋白家族,包括乙酰胆 碱酯酶和脂质酶。在这些酶中,用组气酸活化的亲核试剂可能是半胱氨酸而不是丝氨酸。 小麦羧肽酶Ⅱ有催化三体,但是这个酶与胰凝乳蛋白酶和枯草杆菌蛋白酶都没有明显 的类似性(图9.15)。 最后,还有一类蛋白酶活性位点的丝氨酸或苏氨酸不是用天冬氨酸-组氨酸对活化,而 是用赖氨酸侧链氨基或肽链N-瑞氦基活化。 因此,蛋白酶活性中心的催化三体在进化过程中产生的时间点至少有三个。这类催化策 略在水解肽及相关化学键方面尤为有效。 定,点突变研究催化三体 我们如何肯定活化中心是催化三体结构?用定点突变,然后测定各种变异的影响。用这 种方法研究枯草杆菌蛋白酶的工作很深入。用Ala分别替代催化中心的Asp32,His64,和 Sr221,然后测定各突变蛋白酶切模式底物的活性(图9.16)。 如同所料,活性位点Ser221突变成Ala显著降低催化活性,kcat值只有野生酶kcat的 百万分之一,Km值变化不大。Km值比野生酶Km值高两倍以内。His64突变成Ala64,催
的一个氨基来自天冬酰胺残基的侧链而不是肽链骨架(图 9.14)。枯草杆菌蛋白酶属于另一 蛋白酶家族,在古生菌、细菌、和真核生物发现了这一蛋白酶家族成员。 图 9.14 枯草杆菌的催化三体和氧负离子洞。氧负离子洞的两个氨基分别来自肽链骨架氨基 和 Asn 155 的侧链氨基。这两个氨基能够稳定活性中心 Ser 221 亲核攻击肽键碳原子所形成 的氧负离子。 图 9.15 羧肽酶 II。小麦羧肽酶 II 的结构(右边),有两条肽链(分别用蓝色和红色标出)。 活性中心的催化三体(左边)与胰凝乳蛋白酶的组成相同。但是该酶与胰凝乳蛋白酶没有相 似之处。形成氧离子洞的氨基酸残基用黄色涂出。该蛋白质属于另一蛋白家族,包括乙酰胆 碱酯酶和脂质酶。在这些酶中,用组氨酸活化的亲核试剂可能是半胱氨酸而不是丝氨酸。 小麦羧肽酶 II 有催化三体,但是这个酶与胰凝乳蛋白酶和枯草杆菌蛋白酶都没有明显 的类似性(图 9.15)。 最后,还有一类蛋白酶活性位点的丝氨酸或苏氨酸不是用天冬氨酸-组氨酸对活化,而 是用赖氨酸侧链氨基或肽链 N-端氨基活化。 因此,蛋白酶活性中心的催化三体在进化过程中产生的时间点至少有三个。这类催化策 略在水解肽及相关化学键方面尤为有效。 定点突变研究催化三体 我们如何肯定活化中心是催化三体结构?用定点突变,然后测定各种变异的影响。用这 种方法研究枯草杆菌蛋白酶的工作很深入。用 Ala 分别替代催化中心的 Asp 32,His64,和 Ser221,然后测定各突变蛋白酶切模式底物的活性(图 9.16)。 如同所料,活性位点 Ser 221 突变成 Ala 显著降低催化活性,kcat 值只有野生酶 kcat 的 百万分之一,Km 值变化不大。Km 值比野生酶 Km 值高两倍以内。His64 突变成 Ala64,催

化活性的降低与Ser22lAla突变相当,Asp32突变成Ala32队酶活性的影响幅度稍微小些, 但酶促活性也只有野生酶的万分之零点五。将这三个位点的氨基酸都变成丙氨酸,突变效果 与His64或Sr221单位,点突变的效果相当。这些结果支持“活性中心是催化三体,尤其是 组氨酸-丝氨酸对联合作用产生活性足够的亲核试剂攻击肽键羰基碳原子”的观,点。尽管这 些位点突变会大大降低酶促反应活性,但是在缓冲液pH值为86时,这些突变体的催化蛋 白水解的速度仍然比没有酶催化的蛋白水解速度快1000倍。 Wild type D32A S221A H64A S221A H64A D32A Uncat. =10 图916枯草杆菌蛋白酶定点突变。催化三体的残基突变成丙氨酸后,测定酶促活性。任一 残基突变都显著降低酶促活性。注意,纵轴是对数轴。突变体命名,第一个字母是野生型酶 的氨基酸缩写,后面的数字表示这个氨基酸所在的氨基酸序列位置,后面一个字母表示该位 点的突变氨基酸。Uncat是没有催化剂的反应效率(估计值)。 定点突变也能研究氧离子洞对催化反应的重要性。AsI55突变成甘氨酸能消除枯草杆 菌氧负离子洞的一个氨基,kcat值降至野生型酶的0.2%,Km值增加两倍。这些结果显示天 冬酰胺的NH基团在稳定羰基碳四面体中间物以及形成该四面体的转化态方面起重要作用。 其他种类的肽水解酶是半胱氨酸、天冬氪酸、和金属蛋白酶 并非所有的蛋白水解酶都使用活化丝氨酸残基,还有其它活活残基水解肽键(图9.17)。 这些蛋白水解酶分别是(1)半胱氨酸蛋白水解酶,(2)天冬氨酸蛋白水解酶,和(3)金 属蛋白水解酶。各种蛋白酶都产生一种亲核试剂,攻击肽键羰基碳原子(图918)。 半胱氨酸蛋白酶的酶促机理与胰凝乳蛋白酶酶促机理最相似。半胱氨酸蛋白酶组氨酸 残基活化的半胱氨酸亲核攻击肽键(图9.18)的方式与丝氨酸蛋白酶丝氨酸颇为相似。研究最 深入的半胱氨酸蛋白酶是木瓜蛋白酶(papain)。这个酶是从木瓜分离的。与木瓜蛋白酶同源 的哺乳动物蛋白酶是组织蛋白酶(cathepsins)。组织蛋白酶在免疫系统和其他系统起作用。在 进化过程中,半胱氨酸蛋白酶至少独立出现两次。Caspases也是半胱氨酸蛋白酶,负责细胞 凋亡,但是它们的结构与木瓜蛋白酶没有关系。 天冬氨酸蛋白酶活性位点中心有一对天冬氨酸,它们联合作用活化水分子,后者攻击 肽键。一个天冬氨酸是去质子状态(即解离状态,属于碱催化剂),它攻击水分子使之脱去质 子。另一个天冬氨酸是结合质子的状态(没有解离),使肽键极化导致肽键对亲核攻击敏感 (图9.18)。这类蛋白酶包括肾素。肾素能调解血压和胃蛋白酶(pepsin)活性。天冬氨酸蛋白 酶结构近似二重对称。可能的情况是基因重复产生两考贝基因发生融合,变成编码单一多 肽链的酶。每个考贝基因给活性位点提供一个天冬氨酸。在人免疫缺陷病毒(HV)及其它反 转录病毒中,这两个考贝基因已经融合成编码一条多肽链的基因(图919)。这些结果与酶 早先可能是两个独立亚基的想法一致
化活性的降低与 Ser 221Ala 突变相当,Asp32 突变成 Ala32 队酶活性的影响幅度稍微小些, 但酶促活性也只有野生酶的万分之零点五。将这三个位点的氨基酸都变成丙氨酸,突变效果 与 His64 或 Ser 221 单位点突变的效果相当。这些结果支持“活性中心是催化三体,尤其是 组氨酸-丝氨酸对联合作用产生活性足够的亲核试剂攻击肽键羰基碳原子”的观点。尽管这 些位点突变会大大降低酶促反应活性,但是在缓冲液 pH 值为 8.6 时,这些突变体的催化蛋 白水解的速度仍然比没有酶催化的蛋白水解速度快 1000 倍。 图 9.16 枯草杆菌蛋白酶定点突变。催化三体的残基突变成丙氨酸后,测定酶促活性。任一 残基突变都显著降低酶促活性。注意,纵轴是对数轴。突变体命名,第一个字母是野生型酶 的氨基酸缩写,后面的数字表示这个氨基酸所在的氨基酸序列位置,后面一个字母表示该位 点的突变氨基酸。Uncat 是没有催化剂的反应效率(估计值)。 定点突变也能研究氧离子洞对催化反应的重要性。Asn 155 突变成甘氨酸能消除枯草杆 菌氧负离子洞的一个氨基,kcat 值降至野生型酶的 0.2%,Km 值增加两倍。这些结果显示天 冬酰胺的 NH 基团在稳定羰基碳四面体中间物以及形成该四面体的转化态方面起重要作用。 其他种类的肽水解酶是半胱氨酸、天冬氨酸、和金属蛋白酶 并非所有的蛋白水解酶都使用活化丝氨酸残基,还有其它活活残基水解肽键(图 9.17)。 这些蛋白水解酶分别是(1)半胱氨酸蛋白水解酶,(2)天冬氨酸蛋白水解酶,和(3)金 属蛋白水解酶。各种蛋白酶都产生一种亲核试剂,攻击肽键羰基碳原子(图 9.18)。 半胱氨酸蛋白酶的酶促机理与胰凝乳蛋白酶酶促机理最相似。半胱氨酸蛋白酶组氨酸 残基活化的半胱氨酸亲核攻击肽键(图 9.18)的方式与丝氨酸蛋白酶丝氨酸颇为相似。研究最 深入的半胱氨酸蛋白酶是木瓜蛋白酶(papain)。这个酶是从木瓜分离的。与木瓜蛋白酶同源 的哺乳动物蛋白酶是组织蛋白酶(cathepsins)。组织蛋白酶在免疫系统和其他系统起作用。在 进化过程中,半胱氨酸蛋白酶至少独立出现两次。Caspases 也是半胱氨酸蛋白酶,负责细胞 凋亡,但是它们的结构与木瓜蛋白酶没有关系。 天冬氨酸蛋白酶活性位点中心有一对天冬氨酸,它们联合作用活化水分子,后者攻击 肽键。一个天冬氨酸是去质子状态(即解离状态,属于碱催化剂),它攻击水分子使之脱去质 子。另一个天冬氨酸是结合质子的状态(没有解离),使肽键极化导致肽键对亲核攻击敏感 (图 9.18)。这类蛋白酶包括肾素。肾素能调解血压和胃蛋白酶(pepsin)活性。天冬氨酸蛋白 酶结构近似二重对称。可能的情况是基因重复产生两考贝基因发生融合,变成编码单一多 肽链的酶。每个考贝基因给活性位点提供一个天冬氨酸。在人免疫缺陷病毒(HIV)及其它反 转录病毒中,这两个考贝基因已经融合成编码一条多肽链的基因(图 9.19)。这些结果与酶 早先可能是两个独立亚基的想法一致