第十一章元素化学 144 第十一章元素化学 一、教学基本要求 1.氢卤酸、卤化物 掌握卤化氢性质的变化规律,卤化物的溶解性、水解性(只要求锡、锑、 铋盐的水解):掌握卤离子的性质, 2.氧及氧化物 了解臭氧的结构和性质:掌握过氧化氢的结构与性质:掌握二氧化铅、二 氧化锰的性质。 3.氧化物、含氧酸及其盐 竿握OH规则及鲍林规则:理解含氧酸盐的溶解性与热稳定性:掌握氯的 含氧酸及其盐的主要性质及其变化规律:掌握硫酸、亚硫酸、硫代硫酸、过硫酸 及其盐的性质:掌握硝酸、亚硝酸及其盐的性质:掌握铋酸钠、重铬酸钾、高锰 酸钾的性质。 4.配位化合物 掌握氰合物、异硫氰合物、含氧酸配合物等简单配合物。 二、学时分配: 讲授内容 学时数(10.0) 1.氢卤酸、卤化物 3.5 2.氧及氧化物 2.0 3.氢氧化物、含氧酸及其盐 4.0 4.配位化合物 0.5 三、教学内容 §11一1氢卤酸、卤化物 11.1.1氢卤酸 1.卤化氢的制备 卤化氢的制备可采用由单质合成、复分解和卤化物的水解等方法。 2.卤化氢的性质 卤化氢均为具有强烈刺激性臭味的无色气体,在空气中易与水蒸气结合而形 成白色酸雾.卤化氢是极性分子,极易溶于水,其水溶液称为氢卤酸。卤化氢受 热分解为氢气和相应的卤素:
第十一章 元素化学 144 第十一章 元素化学 一、教学基本要求 1.氢卤酸、卤化物 掌握卤化氢性质的变化规律,卤化物的溶解性、水解性(只要求锡、锑、 铋盐的水解);掌握卤离子的性质。 2.氧及氧化物 了解臭氧的结构和性质;掌握过氧化氢的结构与性质;掌握二氧化铅、二 氧化锰的性质。 3.氧化物、含氧酸及其盐 掌握 ROH 规则及鲍林规则;理解含氧酸盐的溶解性与热稳定性;掌握氯的 含氧酸及其盐的主要性质及其变化规律;掌握硫酸、亚硫酸、硫代硫酸、过硫酸 及其盐的性质;掌握硝酸、亚硝酸及其盐的性质;掌握铋酸钠、重铬酸钾、高锰 酸钾的性质。 4.配位化合物 掌握氰合物、异硫氰合物、含氧酸配合物等简单配合物。 二、学时分配: 讲授内容 学时数(10.0) 1. 氢卤酸、卤化物 3.5 2. 氧及氧化物 2.0 3. 氢氧化物、含氧酸及其盐 4.0 4. 配位化合物 0.5 三、教学内容 §11—1 氢卤酸、卤化物 11.1.1 氢卤酸 1. 卤化氢的制备 卤化氢的制备可采用由单质合成、复分解和卤化物的水解等方法。 2. 卤化氢的性质 卤化氢均为具有强烈刺激性臭味的无色气体,在空气中易与水蒸气结合而形 成白色酸雾.卤化氢是极性分子,极易溶于水,其水溶液称为氢卤酸.卤化氢受 热分解为氢气和相应的卤素:
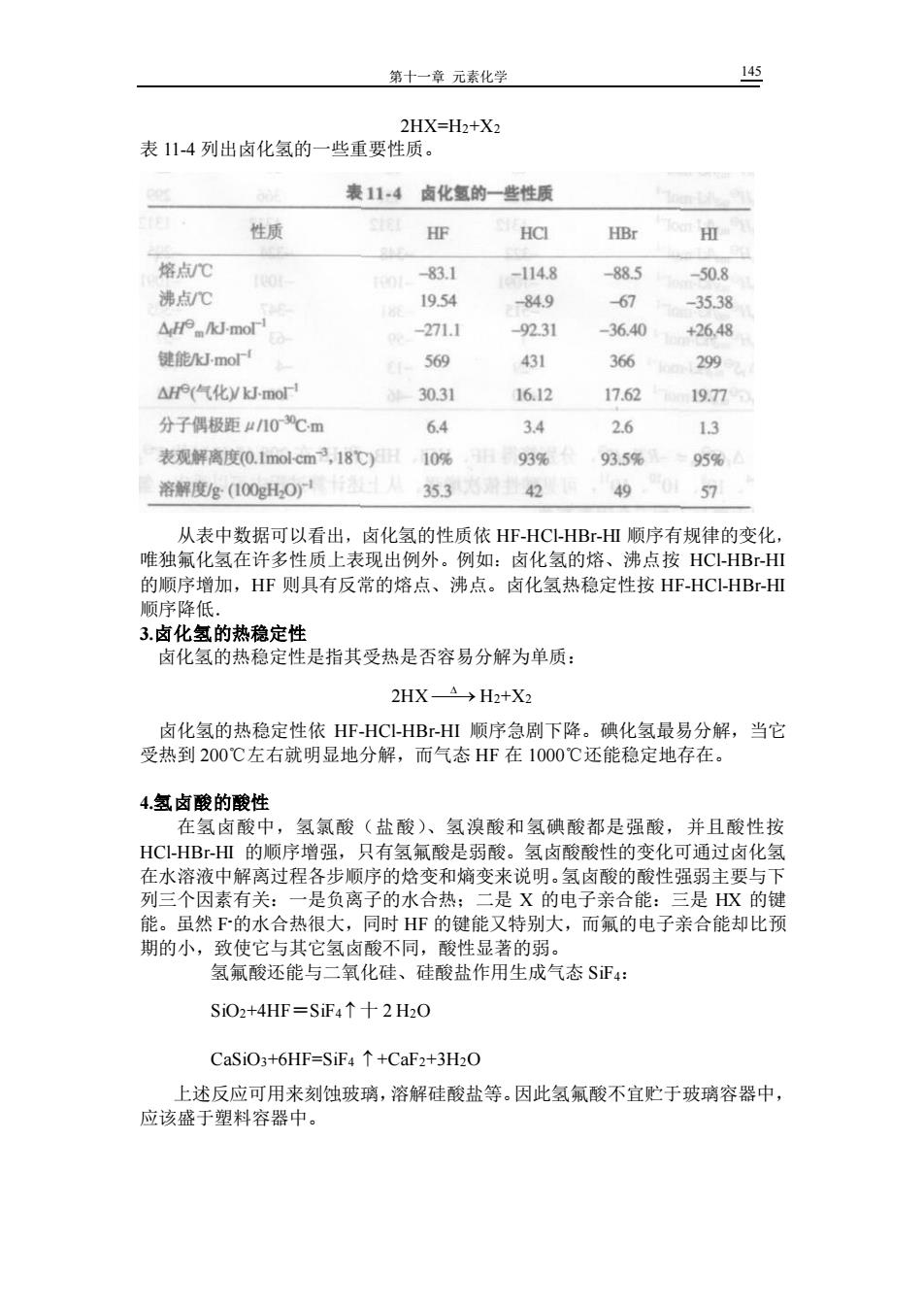
第十一章元素化学 2HX=H2+X2 表14列出卤化氢的一些重要性质, 表114卤化氢的一些性质 性质 HF HCI HBr 用 惊占℃ -83.1 -114.8 -88.5 -50.8 沸点C 19.54 -84.9 67 -35.38 △.Jmor -271.1 9231 -36.40 +26,48 键能mo' 569 431 366 299 △e气化ymo 30.31 16.12 17.62 19.7 分子偶极距r10℃m 6.4 34 2.6 13 表观解离度(0.1 nol cm3,18℃)日10% 93% 935 95% 溶解度g(100gH,O)12 35.3 42 49 57 从表中数据可以看出,卤化氢的性质依HF-HC-HB-HΠ领序有规律的变化 唯独氟化氢在许多性质上表现出例外。例如: 卤化氢的熔、 沸点按HC-HBr-HI 的顺序增加,HF则具有反常的熔点、沸点。卤化氢热稳定性按HF-HC-HBr-Ⅲ 顺序降低。 3.卤化氢的热稳定性 卤化氢的热稳定性是指其受热是否容易分解为单质: 2HXA→H2+X3 卤化氢的热稳定性依HF-HCHBⅢ顺序急剧下降。碘化氢最易分解,当它 受热到200℃左右就明显地分解,而气态HF在1000℃还能稳定地存在。 4.氢卤酸的酸性 在氢卤酸中,氢氯酸(盐酸)、氢溴酸和氢碘酸都是强酸,并且酸性按 HCl-HBr-HⅢ的顺序增强,只有氢氟酸是弱酸。氢卤酸酸性的变化可通过卤化氢 在水溶液中解离过程各步顺序的焓变和熵变来说明,氢卤酸的酸性强弱主要与下 列三个因素有关:一是负离子的水合热:二是X的电子亲合能:三是K的键 能。虽然下的水合热很大,同时HF的键能又特别大,而氟的电子亲合能却比预 期的小, 致使它与其它氢卤酸不同,酸性显著的弱, 氢氟酸还能与二氧化硅、硅酸盐作用生成气态S正4: SiO2+4HF=S证4↑十2H20 CaSiO3+6HF=SiF4+CaF2+3H2O 上述反应可用来刻蚀玻璃,溶解硅酸盐等。因此氢氟酸不宜贮于玻璃容器中, 应该盛于塑料容器中
第十一章 元素化学 145 2HX=H2+X2 表 11-4 列出卤化氢的一些重要性质。 从表中数据可以看出,卤化氢的性质依 HF-HCl-HBr-HI 顺序有规律的变化, 唯独氟化氢在许多性质上表现出例外。例如:卤化氢的熔、沸点按 HCl-HBr-HI 的顺序增加,HF 则具有反常的熔点、沸点。卤化氢热稳定性按 HF-HCl-HBr-HI 顺序降低. 3.卤化氢的热稳定性 卤化氢的热稳定性是指其受热是否容易分解为单质: 2HX ⎯⎯→ H2+X2 卤化氢的热稳定性依 HF-HCl-HBr-HI 顺序急剧下降。碘化氢最易分解,当它 受热到 200℃左右就明显地分解,而气态 HF 在 1000℃还能稳定地存在。 4.氢卤酸的酸性 在氢卤酸中,氢氯酸(盐酸)、氢溴酸和氢碘酸都是强酸,并且酸性按 HCl-HBr-HI 的顺序增强,只有氢氟酸是弱酸。氢卤酸酸性的变化可通过卤化氢 在水溶液中解离过程各步顺序的焓变和熵变来说明。氢卤酸的酸性强弱主要与下 列三个因素有关:一是负离子的水合热;二是 X 的电子亲合能:三是 HX 的键 能。虽然 F -的水合热很大,同时 HF 的键能又特别大,而氟的电子亲合能却比预 期的小,致使它与其它氢卤酸不同,酸性显著的弱。 氢氟酸还能与二氧化硅、硅酸盐作用生成气态 SiF4: SiO2+4HF=SiF4 十 2 H2O CaSiO3+6HF=SiF4 +CaF2+3H2O 上述反应可用来刻蚀玻璃,溶解硅酸盐等。因此氢氟酸不宜贮于玻璃容器中, 应该盛于塑料容器中

第十一章元素化学 146 5.氢卤酸的还原性 氢卤酸的还原强弱可用o日(X2八)数值来衡量和比较。X还原能力的递变 顺序为>B>C>F,事实上HF不能被一般氧化剂所氧化:与一些强氧化剂入 F2,MnO2,KMnO4,PbO2等反应才显还原性:Br和r的还原性较强,空气中的氧就 可以使他们氧化为单质。溴化氢溶液在日光、空气作用下即可变为棕色:而碘化 氢溶液即使在暗处,也会逐渐变为棕色。 11.1.2卤化物 严格地说,卤素与电负性较小的元素所形成的化合物才称为卤化物,例 如卤素与IA、ⅡA族的绝大多数金属形成的离子型卤化物。这些卤化物具有高的 熔、沸点和低挥发性,熔融时能导电。但广义来说,卤化物也包括卤素与非金属、 氧化值较高的金属所形成的共价型卤化物,如SF6、UF6、SnCL4等。共价型卤化 物固态时为分子晶体, 一般熔、沸点低,熔融时不导电,并且有挥发性,如常温 下呈气态的SFo,呈液态的CCh及固态的HsC(升汞),但是离子型卤化物与共 价型卤化物之间没有严格的界限,如FC是易挥发共价型卤化物,它在熔融态 时能导电。卤化物中我们着重讨论氯化物。 1.卤化物的溶解性 大多数卤化物易溶于水。氯、溴、碘的银盐(AgX)、铅盐(PbX)、亚汞盐 (HgX)、亚铜盐(CuX)是难溶的。氟化物的溶解度表现有些反常,例如CF2难 溶,而其它CaX2易溶:AgF易溶,而其它AgX难溶。这是因为钙的卤化物基本 上是离子型的,氟的离子半径小,CF2的晶格能大,致使其难溶。而在AgX系 列中,虽然Ag的极化力和变形性都大,但F半径小难以被极化,故AgF基本 上是离子型的易溶于水:而从C到F 变形性增 Ag相互极化作用增加 键的共价性随之增加,故它们均难溶,且溶解度越来越小。一般来说,重金属卤 化物的溶解度大小次序为: ME.>MCL>MBE>MI 此外,金属卤化物的溶解度常因生成配合物而加大。如]PbC在冷水中溶解度 较小,在HC1溶液中因与C离子形成配离子而增大了溶解度。 PbCl2+Cl=PbCl3 2.卤化物的水解 大多数不太活泼金属(如镁、锌等)的卤化物会不同程度地与水发生反应, 尽管反应常常是分级进行和可逆的,却总会引起溶液酸性的增强。它们与水反应 的产物一般为碱式盐与盐酸,例如: MgCl2+H2O=Mg(OH)CI+HCI 在焊接金属时常用氯化锌浓溶液以清除钢铁表面的氧化物,主要是利用 ZnCh与水反应产生的酸性。而SnC2、SbCs和BiCls水解后分别以碱式氯化亚 锡S(OH)Cl,氯氧化锑SbOCI和氯氧化铋BiOCI的沉淀形式析出。 SnCh十HO=Sn(OH)CI↓+十HCI SbCl3+H2O=SbOCI+2HCI BiCl3十HO=BiOCl↓十2HCI
第十一章 元素化学 146 5.氢卤酸的还原性 氢卤酸的还原强弱可用 (X2/X-)数值来衡量和比较。X-还原能力的递变 顺序为 I ->Br->Cl->F- ,事实上 HF 不能被一般氧化剂所氧化;与一些强氧化剂入 F2,MnO2,KMnO4,PbO2 等反应才显还原性;Br- 和 I -的还原性较强,空气中的氧就 可以使他们氧化为单质。溴化氢溶液在日光、空气作用下即可变为棕色;而碘化 氢溶液即使在暗处,也会逐渐变为棕色。 11.1.2 卤化物 严格地说,卤素与电负性较小的元素所形成的化合物才称为卤化物,例 如卤素与 IA、IIA 族的绝大多数金属形成的离子型卤化物。这些卤化物具有高的 熔、沸点和低挥发性,熔融时能导电。但广义来说,卤化物也包括卤素与非金属、 氧化值较高的金属所形成的共价型卤化物,如 SF6、UF6、SnCl4 等。共价型卤化 物固态时为分子晶体,一般熔、沸点低,熔融时不导电,并且有挥发性,如常温 下呈气态的 SF6,呈液态的 CCl4 及固态的 HgCl2(升汞)。但是离子型卤化物与共 价型卤化物之间没有严格的界限,如 FeCl3 是易挥发共价型卤化物,它在熔融态 时能导电。卤化物中我们着重讨论氯化物。 1.卤化物的溶解性 大多数卤化物易溶于水。氯、溴、碘的银盐(AgX)、铅盐(PbX2)、亚汞盐 (HgX2)、亚铜盐(CuX)是难溶的。氟化物的溶解度表现有些反常,例如 CaF2 难 溶,而其它 CaX2 易溶;AgF 易溶,而其它 AgX 难溶。这是因为钙的卤化物基本 上是离子型的,氟的离子半径小,CaF2 的晶格能大,致使其难溶。而在 AgX 系 列中,虽然 Ag+的极化力和变形性都大,但 F -半径小难以被极化,故 AgF 基本 上是离子型的易溶于水;而从 Cl-到 I -,变形性增大,与 Ag+相互极化作用增加, 键的共价性随之增加,故它们均难溶,且溶解度越来越小。一般来说,重金属卤 化物的溶解度大小次序为: MFn MCln>MBrn>MIn 此外,金属卤化物的溶解度常因生成配合物而加大。如]PbCl2 在冷水中溶解度 较小,在 HCl 溶液中因与 Cl-离子形成配离子而增大了溶解度。 PbCl2+ Cl-= PbCl3 - 2.卤化物的水解 大多数不太活泼金属(如镁、锌等)的卤化物会不同程度地与水发生反应, 尽管反应常常是分级进行和可逆的,却总会引起溶液酸性的增强。它们与水反应 的产物一般为碱式盐与盐酸,例如: MgCl2 十 H2O=Mg(OH)Cl+HCl 在焊接金属时常用氯化锌浓溶液以清除钢铁表面的氧化物,主要是利用 ZnCl2 与水反应产生的酸性。而 SnCl2、SbCl3 和 BiCl3 水解后分别以碱式氯化亚 锡 Sn(OH)Cl,氯氧化锑 SbOCl 和氯氧化铋 BiOCl 的沉淀形式析出。 SnCl2 十 H2O=Sn(OH)Cl +十 HCl SbCl3+H2O= SbOCl +2HCI BiCl3 十 H2O =BiOCl 十 2 HCI

第十一章元素化学 14 所以在配制这些盐溶液时,为了防止沉淀产生,应将盐类先溶于浓盐酸, 然后再加水稀释 较高价态金属的卤化物(如FeC、A1C、CrCb)片水反应的过程比较复 杂,不要求掌握。 11.1.3卤离子X)的性质 1还原性 卤素获得电子成为氧化值为1的X离子的标准电极电势如下: 电对 F/F Cl/CI Br/Br I2/I- 08/V2.871361.090.536 可知卤素单质的氧化性F2>C12>Br2>2,卤素离子的还原性>B>C>F,因 此每种卤素 可以把电负性比它小的卤素从后者的卤化物中置换出来。 例如氟可 以从固态氯化物、溴化物、碘化物中分别置换氯、溴、碘:氯可以从溴化物、碘 化物的溶液中置换出溴、碘;而溴只能从碘化物的溶液中置换出碘。 具有较强的还原性,遇氧化剂F3+等)可发生如下反应: 2Fe3+十2r)2Fe2+l2 而在水溶液中,Cu2+的氧化性不算强,由下列电对的o8值来看,似乎Cu2*难 把氧化。 Cu2+十e=Cutp8-0.153V 2十2e-2r00-0.536V 但实际上却能发生下列反应: 2Cu2+4=2Cul↓+I2 这是由于Cu与r反应生成了难溶于水的Cul,使溶液中Cu的浓度变得很小, 使中p8(Cu2+/Cu变大,相对来说Cu2*的氧化性增强了。CuX是难溶盐,但在 过量的浓X溶液中,易形成稳定的CXz而溶解。 2.配位性 卤素离子能与金属和非金属离子形成名种配合物.如H下可通村雄与活泼 金属的氟化物形成各种“酸式盐”,如KHF:(KF-HF)、NaHF:(NaF-.HF)等:还可 与四氟化硅直接生成比HSO,酸性还强的氟硅酸 SiF4+2HF=2H*十SiF62- 例如CdS、SbS等不溶于水和弱酸,但能溶于浓HCI也是因为生成了CdCl42: 和SbCl63-配离子的缘故。 Hg2在过量离子存在下由于形成曲Hgl4P离子而溶解。 Hgl2+2I=[Hgl4P 碘难溶于水,但易溶于碘化物(如碘化钾)中,主要是由于形成1的缘故。 I2+2I=I3° 【g可以离解生成2,故多碘化物溶液的性质实际上和碘溶液相同,实验室常用
第十一章 元素化学 147 所以在配制这些盐溶液时,为了防止沉淀产生,应将盐类先溶于浓盐酸, 然后再加水稀释。 较高价态金属的卤化物(如 FeCl3、AlCl3、CrCl3)与水反应的过程比较复 杂,不要求掌握。 11.1.3 卤离子(X- )的性质 1.还原性 卤素获得电子成为氧化值为-1 的 X-离子的标准电极电势如下: 电对 F/F - Cl2/ Cl- Br/Br- I2/I- /V 2.87 l.36 1.09 0.536 可知卤素单质的氧化性 F2>C12>Br2> I2,卤素离子的还原性 I ->Br->Cl->F-,因 此每种卤素都可以把电负性比它小的卤素从后者的卤化物中置换出来。例如氟可 以从固态氯化物、溴化物、碘化物中分别置换氯、溴、碘;氯可以从溴化物、碘 化物的溶液中置换出溴、碘;而溴只能从碘化物的溶液中置换出碘。 I -具有较强的还原性,遇氧化剂(Fe3+等)可发生如下反应: 2 Fe3+十 2 I-→ 2Fe2++I2 而在水溶液中,Cu2+的氧化性不算强,由下列电对的 值来看,似乎 Cu2+难 把 I -氧化。 Cu2+十 e -=Cu+ =0.153V I2 十 2e-=2 I- =0.536V 但实际上却能发生下列反应: 2Cu2++4 I-=2CuI + I2 这是由于 Cu+与 r 反应生成了难溶于水的 CuI,使溶液中 Cu+的浓度变得很小, 使中 (Cu2+/Cu+ )变大,相对来说 Cu2+的氧化性增强了。CuX 是难溶盐,但在 过量的浓 X-溶液中,易形成稳定的 CuX2 -而溶解。 2.配位性 卤素离子能与金属和非金属离子形成多种配合物,如 HF 可通过氢键与活泼 金属的氟化物形成各种“酸式盐”,如 KHF2(KF-HF)、NaHF2(NaF-HF)等:还可 与四氟化硅直接生成比 H2SO4 酸性还强的氟硅酸。 SiF4+2HF=2H+十 SiF6 2- 例如 CdS、Sb2S3 等不溶于水和弱酸,但能溶于浓 HCl 也是因为生成了 CdCl4 2- 和 SbCl6 3-配离子的缘故。 HgI2 在过量 I -离子存在下由于形成曲[HgI4] 2-离子而溶解。 HgI2+2 I -=[HgI4] 2- 碘难溶于水,但易溶于碘化物(如碘化钾)中,主要是由于形成 I3 -的缘故。 I2+2I -= I3 - I3 -可以离解生成 I2,故多碘化物溶液的性质实际上和碘溶液相同,实验室常用

第十一章元素化学 148 此反应获得较大浓度的碘水溶液。 从铜的电势图: Cu2+015Cut0.52L 可看出,因此在水流中发生发反限大即在衡时溶 中绝大部分Cu转变为Cu2+和Cu。例如Cu0溶于稀CSO4中,得到的不是 Cu2SO4而是CuSO4和Cu: CIo++HSO=Cu+CusotHO 只有当Cu形成沉淀或配合物时,C浓度被大大减小,该歧化反应才能向反方向 进行 例如铜与氯化铜在热浓盐酸中形成+1价铜的化合物: Cu+CuCl2=2CuCI↓ 由于生设代液中游商的C如浓度非常小,反应可续向右进行直 到完全 将制得的CuC溶液倒入大量水中稀释,会有白色氯化亚铜CuCI沉淀析出: [CuCb时CuC1↓+Cr 与铜的电势图不同,在酸性溶液中汞的电势图如下: Hg2+0.920 Hg22+0797 Hg 可以看出o日右<o8左,因此在水溶液中Hg2+不会发生歧化反应,相反Hg2*却 可以将Hg氧化Hg22+: Hg2+Hg→Hg22+K8=[Hg22*]MHg2*]=166(25℃) 这说明在平衡状态了 绝大多数Hg2*可转变Hg2 以上反应的K日值还不是很大,采取适当措施也可以使平衡向歧化反应方向 移动,如加入一种试剂和Hg2+形成沉淀(如OH、NH、S2、CO2)或形成配合物 (如,CN-等),大大降低溶液中的Hg+浓度,就会促使Hg*歧化反应的进行。 例如,加入一种试剂如,能与Hg+形成稳定的配离子HgP大大降低了 Hg+的浓度,就会促使上面反应向左进行,使Hg2*的歧化反应得以进行 Hg22++4I=[Hgl4]2-+Hg 顺便指出,加入的试剂与Hg+形成的沉淀有许多是不稳定的,也会发生歧化反 应。例如: Hg22+H2S=HgS↓+Hg↓+2H Hg22+20H=Hg0↓+Hg↓+H0 白色难溶的Hg2C12中加入氨水时也会发生以下歧化反应: Hg2C12+2NH=HgNH2Cl4(伯+Hg(黑)+HNH4CI1 此反应常用来检验Hg22+
第十一章 元素化学 148 此反应获得较大浓度的碘水溶液。 从铜的电势图: Cu2+ 0.153 Cu+ 0.521 Cu 可看出,因此在水溶液中 Cu+易发生歧化反应,且 K 值很大,即在平衡时溶液 中绝大部分 Cu+转变为 Cu2+和 Cu。例如 Cu2O 溶于稀 Cu2SO4 中,得到的不是 Cu2SO4 而是 CuSO4和 Cu: Cu2O 十 H2SO4=Cu+CuSO4+H2O 只有当 Cu+形成沉淀或配合物时, Cu+浓度被大大减小,该歧化反应才能向反方向 进行, 例如铜与氯化铜在热浓盐酸中形成+1 价铜的化合物: Cu+CuCl2=2CuCl CuCl+HCl=HCuCl2 由于生成配离子[CuCl2] -溶液中游离的 Cu+浓度非常小,反应可继续向右进行直 到完全。 将制得的[CuCl2] -溶液倒入大量水中稀释,会有白色氯化亚铜 CuCl 沉淀析出: [CuCl2] - ⎯稀释⎯→ CuCl +CI- 与铜的电势图不同,在酸性溶液中汞的电势图如下: Hg2+ 0.920 Hg2 2+ 0.797 Hg 可以看出 右< 左,因此在水溶液中 Hg2 2+不会发生歧化反应,相反 Hg2+却 可以将 Hg 氧化 Hg2 2+: Hg2+十 Hg → Hg2 2+ K =[ Hg2 2+]/[ Hg2+] =166(25℃) 这说明在平衡状态下,绝大多数 Hg2+可转变 Hg2 2+。 以上反应的 K 值还不是很大,采取适当措施也可以使平衡向歧化反应方向 移动,如加入一种试剂和 Hg2+形成沉淀(如 OH-、NH3、S 2-、CO3 2- )或形成配合物 (如 I -,CN-等),大大降低溶液中的 Hg2+浓度,就会促使 Hg2 2+歧化反应的进行。 例如,加入一种试剂如 I -,能与 Hg2+形成稳定的配离子[HgI4] 2-大大降低了 Hg2+的浓度,就会促使上面反应向左进行,使 Hg2 2+的歧化反应得以进行: Hg2 2++ 4I-=[HgI4] 2-+Hg 顺便指出,加入的试剂与 Hg2 2+形成的沉淀有许多是不稳定的,也会发生歧化反 应。例如: Hg2 2++H2S=HgS +Hg +2H+ Hg2 2++2 OH-=HgO +Hg +H2O 白色难溶的 Hg2C12 中加入氨水时也会发生以下歧化反应: Hg2C12+2NH3=HgNH2Cl (白)+ Hg (黑)+lNH4Cl 此反应常用来检验 Hg2 2+