第十章品体结构 131 第十章 晶体结构 一、教学基本要求 1.晶体的类型 熟悉晶体的特征和晶体的分类。 2.共价型物质的品体 了解金属键理论和金属晶体:掌握分子的极性、分子间力、氢键及对物质性质的影响, 3.离子型晶体 熟悉相应的离子特征(离子半径、离子的电子构型),了解离子晶体结构,掌握晶格 能的概念(不要求计算)。理解离子极化的概念及离子极化对化合物性质的影响。 二、学时分配: 授 内 容 学时数(5.0)■ 1.晶体的类型 1.0 2.共价型物质的晶体 1.5 3.离子型晶体 1.5 三、教学内容 10.1晶体类型 自然界绝大多数物质是以固态形式存在,所以研究固体的存在和性质就显得非常重要 固态物质可以按照其中原子排列的有序程度分为晶体和非晶体。晶体又分单晶体和多晶体。 10.1.1晶体的特征 与非品体相比,晶体通常有如下特征:有一定的几何外形 有固定的熔点、各向异性 .晶体具有一定的几何形状,其内部质点(分子、原子或离子)在空间有规律地重复排列, 如氯化钠、石英、磁铁矿等均为晶体。 非晶体(无定形物质)则没有一定的结晶外形,质点的排列没有规律,如玻璃、石蜡都 是无定形物质。不定形物质往往是在温度突然下降到液体的凝固点以下成为过冷液体时,物 质的质点来不及进行有规则的排列而形成的 晶体有固定的熔点。 时便开始熔化。继续加热时,在晶体没有完全 熔化以前,温度保持恒定,待晶体完全熔化后,温度才开始上升。因此晶体具有固定的熔点, 这是品体的又一特征。 而非晶体(无定形物质)没有固定的熔点。如玻璃、石蜡等。当加热非晶体时,升高到 某一温度后开始软化,流动性增加,最后变成液体。从软化到完全熔化的过程中,温度是不 断上升的, 有固定的熔点,只台 二段软化的温度范围 C.晶体具有各向异性。晶体中各个方向排列的质点间的距离和取向不同,因此晶体是 各向异性的,即在不同方向上有不同的性质。例如石墨容易沿层状结构的方向断裂,石墨在 与层平行方向上的导电率比与层垂直方向上的导电率要高1万倍以上,各向异性是品体的重 要特征。 非晶体的无规则排列决定了它们是各向同性的。 由此可见,规则的几何外形、固定的熔点、各向异性以及对称性等是晶体的几个宏观基 本特征
第十章 晶体结构 131 第十章 晶体结构 一、教学基本要求 1.晶体的类型 熟悉晶体的特征和晶体的分类。 2.共价型物质的晶体 了解金属键理论和金属晶体;掌握分子的极性、分子间力、氢键及对物质性质的影响。 3.离子型晶体 熟悉相应的离子特征(离子半径、离子的电子构型),了解离子晶体结构,掌握晶格 能的概念(不要求计算)。理解离子极化的概念及离子极化对化合物性质的影响。 二、学时分配: 讲 授 内 容 学时数(5.0) 1.晶体的类型 1.0 2.共价型物质的晶体 1.5 3.离子型晶体 1.5 三、教学内容 10.1 晶体类型 自然界绝大多数物质是以固态形式存在,所以研究固体的存在和性质就显得非常重要。 固态物质可以按照其中原子排列的有序程度分为晶体和非晶体。晶体又分单晶体和多晶体。 10.1.1 晶体的特征 与非晶体相比,晶体通常有如下特征:有一定的几何外形、有固定的熔点、各向异性。 a.晶体具有一定的几何形状,其内部质点(分子、原子或离子)在空间有规律地重复排列, 如氯化钠、石英、磁铁矿等均为晶体。 非晶体(无定形物质)则没有一定的结晶外形,质点的排列没有规律,如玻璃、石蜡都 是无定形物质。不定形物质往往是在温度突然下降到液体的凝固点以下成为过冷液体时,物 质的质点来不及进行有规则的排列而形成的。 b.晶体有固定的熔点。晶体在一定温度时便开始熔化。继续加热时,在晶体没有完全 熔化以前,温度保持恒定,待晶体完全熔化后,温度才开始上升。因此晶体具有固定的熔点, 这是晶体的又一特征。 而非晶体(无定形物质)没有固定的熔点。如玻璃、石蜡等。当加热非晶体时,升高到 某一温度后开始软化,流动性增加,最后变成液体。从软化到完全熔化的过程中,温度是不 断上升的,没有固定的熔点,只能说有一段软化的温度范围。 C.晶体具有各向异性。晶体中各个方向排列的质点间的距离和取向不同,因此晶体是 各向异性的,即在不同方向上有不同的性质。例如石墨容易沿层状结构的方向断裂,石墨在 与层平行方向上的导电率比与层垂直方向上的导电率要高1万倍以上,各向异性是晶体的重 要特征。 非晶体的无规则排列决定了它们是各向同性的。 由此可见,规则的几何外形、固定的熔点、各向异性以及对称性等是晶体的几个宏观基 本特征

第十章品体结构 10.1.2晶体的分类 一、晶体的内部结构 品格:把品体中的粒子(原子、离子或分子)抽象地看成 个点(并称为结点),沿着一定 方向,按照某种规则把结点联结起来,则可以得到描述各种晶体内部结构的空间图像,称为 晶格。 晶胞:在晶格中,能表现出其结构一切特征的最小部分称为晶胞。换言之,整个晶体就 是由晶胞堆而成。晶胞的大小和形状由6个参数来决定。 二、四种类型晶体的结构和特征 根据晶胞结构单元间作用力性质的不同,晶体又可分为四个基本类型:离子晶体、原子 晶体、金属晶体和分子晶体。表10-1归纳了四类晶体的结构和特性。 表10-1四类晶体的结构和特性 品格类型 组成晶 的质点 结合力 晶体的特料 实例 原子晶体 原子 共价健 硬度大,熔、沸点很高,在大多数溶剂 金刚石 中不溶,导电性差 正惠 离子品体 负离于 离子 熔、沸点高,硬而脆,大多溶于极性溶 中,培融状态和水溶液能导电 NaCl.CsCl.ZnS 极性分子 分子间力 熔、沸点低,能帝于极性溶剂中,溶于 HCl,HF,NH 水时能导电 H.O 分子品体 非极性分子 分子间力 、沸点低,能溶于极性成极性 的溶剂中 H:.Cl 金属品体 金属健 有金属光桶,电和热的良导体,有延 Na,W.Ag,Au 展性,熔、沸点较高 10.2共价型物质的晶体 10.2.1金属晶体 一、金属键理论 自由电子模型:金属原子电负性、电离能较小,价电子容易脱离原子的束缚,这些价电 子类似理想气体分子一样,在阳离子之间可以自由运动,形成了离域的自由电子气。自由电 子把金属阳离子胶合成金属晶体。金属晶体中由于金属原子间的作用力称为金属键。金属键 没有方向性和饱和性,所以金属品格的结构力求金属原子的密堆积。最紧密的堆积往往是最 稳定的结构(金属离子间的价电子具有最大的重叠)
第十章 晶体结构 132 10.1.2 晶体的分类 一、晶体的内部结构 晶格:把晶体中的粒子(原子、离子或分子)抽象地看成一个点(并称为结点),沿着一定 方向,按照某种规则把结点联结起来,则可以得到描述各种晶体内部结构的空间图像,称为 晶格。 晶胞:在晶格中,能表现出其结构一切特征的最小部分称为晶胞。换言之,整个晶体就 是由晶胞堆砌而成。晶胞的大小和形状由 6 个参数来决定。 二、四种类型晶体的结构和特征 根据晶胞结构单元间作用力性质的不同,晶体又可分为四个基本类型:离子晶体、原子 晶体、金属晶体和分子晶体。表 10-1 归纳了四类晶体的结构和特性。 表 10-1 四类晶体的结构和特性 10.2 共价型物质的晶体 10.2.1 金属晶体 一、金属键理论 自由电子模型:金属原子电负性、电离能较小,价电子容易脱离原子的束缚,这些价电 子类似理想气体分子一样,在阳离子之间可以自由运动,形成了离域的自由电子气。自由电 子把金属阳离子胶合成金属晶体。金属晶体中由于金属原子间的作用力称为金属键。金属键 没有方向性和饱和性,所以金属晶格的结构力求金属原子的密堆积。最紧密的堆积往往是最 稳定的结构(金属离子间的价电子具有最大的重叠)

第十章品体结构 133 二、金属晶体 在晶体中组成晶格的质点排列的是金属原子或金属离子,质点间的作用力是金属键力 该晶体称为金 偶体 金属晶体中排列着的是中性原子或金属正离子金属原子中只有少数价电子能用于成键 这样少的价电子不足以是金属原子间形成正规的离子键或共价键。因此金属在形成晶体时倾 向于形成组成极为紧密的结构,使每个原子拥有尽可能多的相邻原子。从X射线衍射分析测 定,证明大多数金属单质都是且右较简单的第径周球密谁积结物。金属品休中金属原子可可 看成是半径相等的圆球。它们的密堆积方式,可以看成是等径圆球的堆积。 图10-1六方紧密堆积 图10-2面心立方紧密堆积 图10-3体心立方紧密堆积 金属晶体的堆积方式主要有三种:六方紧密堆积、面心立方紧密堆积、体心立方紧密堆积。 六方紧密堆积方式的空间利用率是74.05%,配位数是12,属于六方晶格,称为六方紧 密堆积。如图10-1。 面心立方紧密堆积方式的空间利用率也是74.05%,配位数也是12,属于面心立方格子 称为面心立方紧密堆积。 如图10一2。 体心立方紧密堆积配位数是8,空间利用率是68.02%。这种堆积同层圆球是按正方形排 列的,每个圆球位于另8个圆球为顶角组成的立方体的中心,如图10-3,称为体心立方密堆积。 特点:金属晶体具有良好的导电、导热性和延展性。大多金属具有较高的熔沸点、较高 的使度。熔点最高的是金属钨(3410℃)。熔点最低的是金属汞(-38.87℃)。 10.2.2分子晶体 一、分子极性偶极矩 分子有无极性取决于整个分子的正负电荷的中心是否重合。如果分子的正负电荷的中心 重合,则为非极性分子反之则为极性分子。 用偶极矩μ来衡量。μ=q·d(q表示正、负电荷中心的电量:d表示正负电荷中心间距离)。 图10-4分子的偶极距
第十章 晶体结构 133 二、金属晶体 在晶体中组成晶格的质点排列的是金属原子或金属离子,质点间的作用力是金属键力, 该晶体称为金属晶体。 金属晶体中排列着的是中性原子或金属正离子金属原子中只有少数价电子能用于成键。 这样少的价电子不足以是金属原子间形成正规的离子键或共价键。因此金属在形成晶体时倾 向于形成组成极为紧密的结构,使每个原子拥有尽可能多的相邻原子。从X射线衍射分析测 定,证明大多数金属单质都是具有较简单的等径圆球密堆积结构。金属晶体中金属原子可以 看成是半径相等的圆球。它们的密堆积方式,可以看成是等径圆球的堆积。 图10-1 六方紧密堆积 图10-2面心立方紧密堆积 图10-3体心立方紧密堆积 金属晶体的堆积方式主要有三种:六方紧密堆积、面心立方紧密堆积、体心立方紧密堆积。 六方紧密堆积方式的空间利用率是74.05%,配位数是12,属于六方晶格,称为六方紧 密堆积。如图10-1。 面心立方紧密堆积方式的空间利用率也是74.05%,配位数也是12,属于面心立方格子, 称为面心立方紧密堆积。如图10-2。 体心立方紧密堆积配位数是8,空间利用率是68.02%。这种堆积同层圆球是按正方形排 列的,每个圆球位于另8个圆球为顶角组成的立方体的中心,如图10-3,称为体心立方密堆积。 ▪ 特点:金属晶体具有良好的导电、导热性和延展性。大多金属具有较高的熔沸点、较高 的硬度。熔点最高的是金属钨(3410℃)。熔点最低的是金属汞(-38.87℃)。 10.2.2 分子晶体 一、分子极性 偶极矩 分子有无极性取决于整个分子的正负电荷的中心是否重合。如果分子的正负电荷的中心 重合,则为非极性分子;反之则为极性分子。 用偶极矩μ来衡量。μ=q·d (q 表示正、负电荷中心的电量;d 表示正负电荷中心间距离)。 d 图 10-4 分子的偶极距 +q —q
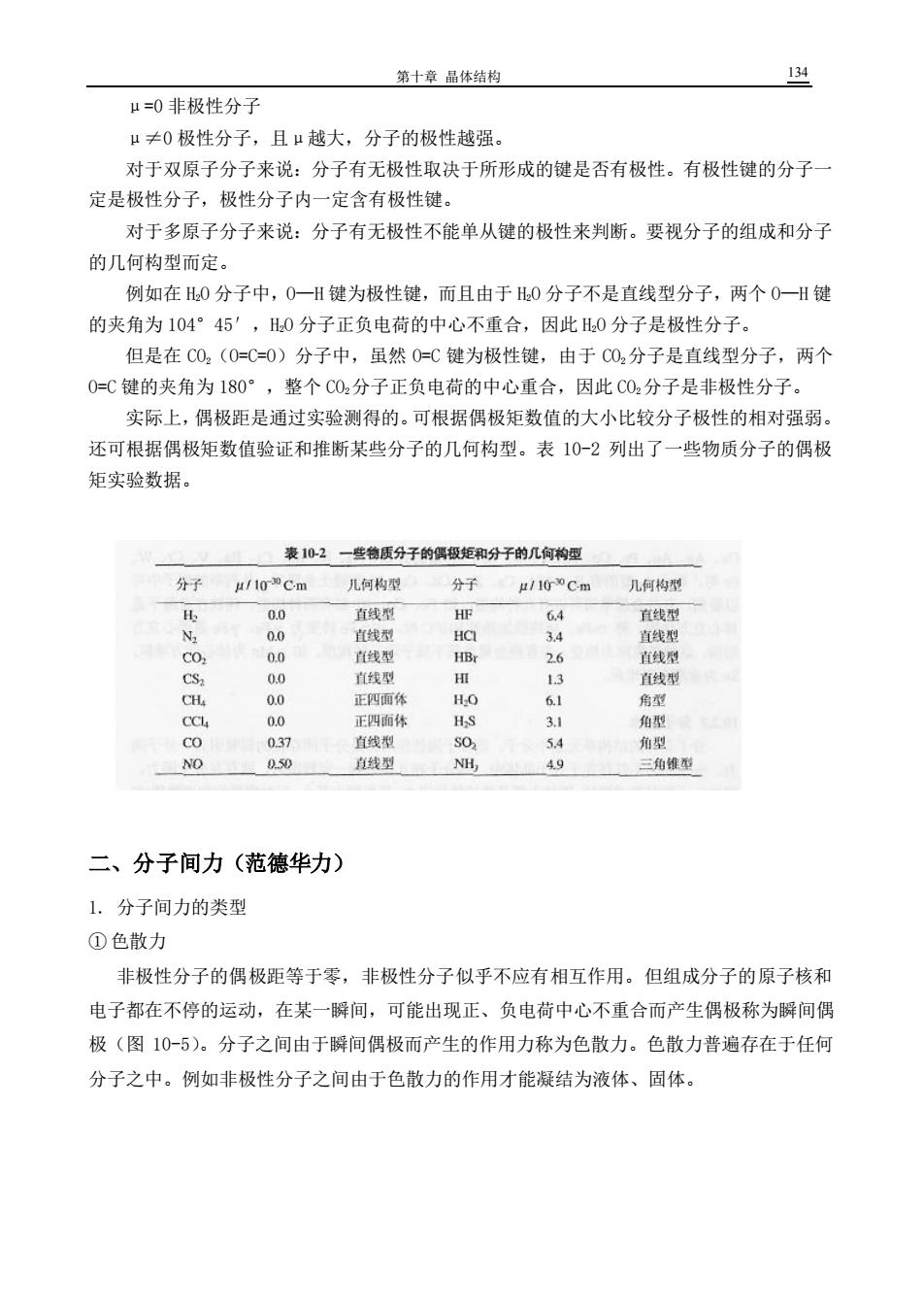
第十章品体结构 134 μ=0非极性分子 μ≠0极性分子,且μ越大,分子的极性越强 对于双原子分子来说:分子有无极性取决于所形成的键是否有极性。有极性键的分子 定是极性分子,极性分子内一定含有极性键。 对于多原子分子来说:分子有无极性不能单从键的极性来判断。要视分子的组成和分子 的几何构型而定。 例如在0分子中,0一H键为极性键,而且由于0分子不是直线型分子,两个0一H键 的夹角为104°45',H0分子正负电荷的中心不重合,因此0分子是极性分子。 但是在C0,(0=C=0)分子中,虽然0=C键为极性键,由于C02分子是直线型分子,两个 0=C键的夹角为180°,整个C02分子正负电荷的中心重合,因此C02分子是非极性分子。 实际上,偶极距是通过实验测得的。可根据偶极矩数值的大小比较分子极性的相对强弱。 还可根据偶极矩数值验证和推断某些分子的几何构型。表10-2列出了一些物质分子的偶极 矩实验数据。 表102一些物质分子的偶极矩和分子的几何构厘 分子 μ/10Cm 儿何构型 分子 几何构型 00 直线型 HE 64 直线型 00 宜直线型 4 直线型 CO. 0.0 直线型 H 26 直生侧 直线型 直线型 正四面体 HO 6 角的 正四面体 角形 037 直线型 30 54 角生 NO 050 线型 NH, 49 三角维型 二、分子间力(范德华力) 1.分子间力的类型 ①色散力 非极性分子的偶极距等于零,非极性分子似乎不应有相互作用。但组成分子的原子核和 电子都在不停的运动,在某一解间,可能出现正、负电荷中心不重合而产生偶极称为瞬间偶 极(图10-5)。分子之间由于瞬间偶极而产生的作用力称为色散力。色散力普遍存在于任何 分子之中。例如非极性分子之间由于色散力的作用才能凝结为液体、固体
第十章 晶体结构 134 μ=0 非极性分子 μ≠0 极性分子,且μ越大,分子的极性越强。 对于双原子分子来说:分子有无极性取决于所形成的键是否有极性。有极性键的分子一 定是极性分子,极性分子内一定含有极性键。 对于多原子分子来说:分子有无极性不能单从键的极性来判断。要视分子的组成和分子 的几何构型而定。 例如在 H2O 分子中,O—H 键为极性键,而且由于 H2O 分子不是直线型分子,两个 O—H 键 的夹角为 104°45′,H2O 分子正负电荷的中心不重合,因此 H2O 分子是极性分子。 但是在 CO2(O=C=O)分子中,虽然 O=C 键为极性键,由于 CO2分子是直线型分子,两个 O=C 键的夹角为 180°,整个 CO2分子正负电荷的中心重合,因此 CO2分子是非极性分子。 实际上,偶极距是通过实验测得的。可根据偶极矩数值的大小比较分子极性的相对强弱。 还可根据偶极矩数值验证和推断某些分子的几何构型。表 10-2 列出了一些物质分子的偶极 矩实验数据。 二、分子间力(范德华力) 1. 分子间力的类型 ① 色散力 非极性分子的偶极距等于零,非极性分子似乎不应有相互作用。但组成分子的原子核和 电子都在不停的运动,在某一瞬间,可能出现正、负电荷中心不重合而产生偶极称为瞬间偶 极(图 10-5)。分子之间由于瞬间偶极而产生的作用力称为色散力。色散力普遍存在于任何 分子之中。例如非极性分子之间由于色散力的作用才能凝结为液体、固体

第十章品体结构 135 (+- 某个瞬间 段时间内 的总体状况 6 图10-5非极性分子间的相互作用 ②诱导力 极性分子相当于一个小电场,它使另一个极性分子或非极性分子发生极化变形而产生诱 导偶极。诱导偶极和固有偶极之间的作用力称为诱导力。在极性分子和非极性分子之间、极 性分子和极性分子之间(图10-6c)会产生诱导偶极。 取向力 极性分子和极性分子之间由于正负极定向排列而产生的作用力称为取向力(图10-6b)。 分子偶极矩越大,取向力越大:分子之间距离越小,取向力越大。 +>+ 长D ) n分子离得较远 b取向 c诱导 图10-6极性分子间相互作用 总之,非极性分子之间只有色散力:非极性分子一极性分子之间有色散力和诱导力:极 性分子一极性分子有色散力、诱导力和取向力。 2.分子间力的特点 ①分子间力是存在分子之间的一种电性作用力。 ②分子间力的作用范围很小,(一般在300-500pm)。 ③分子间作用能的大小一般比化学键能小1∽2个数量级主要影响物质的物理性质。 一般无方向性和饱和性】 ⑤在三种力中,色散力为主要作用力。色散力》诱导力>取向力 3.分子间力对物质的性质的影响 分子间力对物质的物理化学性质如熔点、沸点、熔化热、汽化热、溶解度和粘度等都会 产生较大的影响
第十章 晶体结构 135 某个瞬间 一段时间内 的总体状况 a b c 图 10-5 非极性分子间的相互作用 ② 诱导力 极性分子相当于一个小电场,它使另一个极性分子或非极性分子发生极化变形而产生诱 导偶极。诱导偶极和固有偶极之间的作用力称为诱导力。在极性分子和非极性分子之间、极 性分子和极性分子之间(图 10-6c)会产生诱导偶极。 ③ 取向力 极性分子和极性分子之间由于正负极定向排列而产生的作用力称为取向力(图 10-6b)。 分子偶极矩越大,取向力越大;分子之间距离越小,取向力越大。 图 10-6 极性分子间相互作用 总之,非极性分子之间只有色散力;非极性分子—极性分子之间有色散力和诱导力;极 性分子—极性分子有色散力、诱导力和取向力。 2. 分子间力的特点 ①分子间力是存在分子之间的一种电性作用力。 ②分子间力的作用范围很小,(一般在 300-500pm)。 ③分子间作用能的大小一般比化学键能小 1∽2 个数量级主要影响物质的物理性质。 ④一般无方向性和饱和性。 ⑤在三种力中,色散力为主要作用力。色散力》诱导力>取向力 3.分子间力对物质的性质的影响 分子间力对物质的物理化学性质如熔点、沸点、熔化热、汽化热、溶解度和粘度等都会 产生较大的影响。 + — — + — — + — — — — + ——— + + — — + — — — —— — + — +