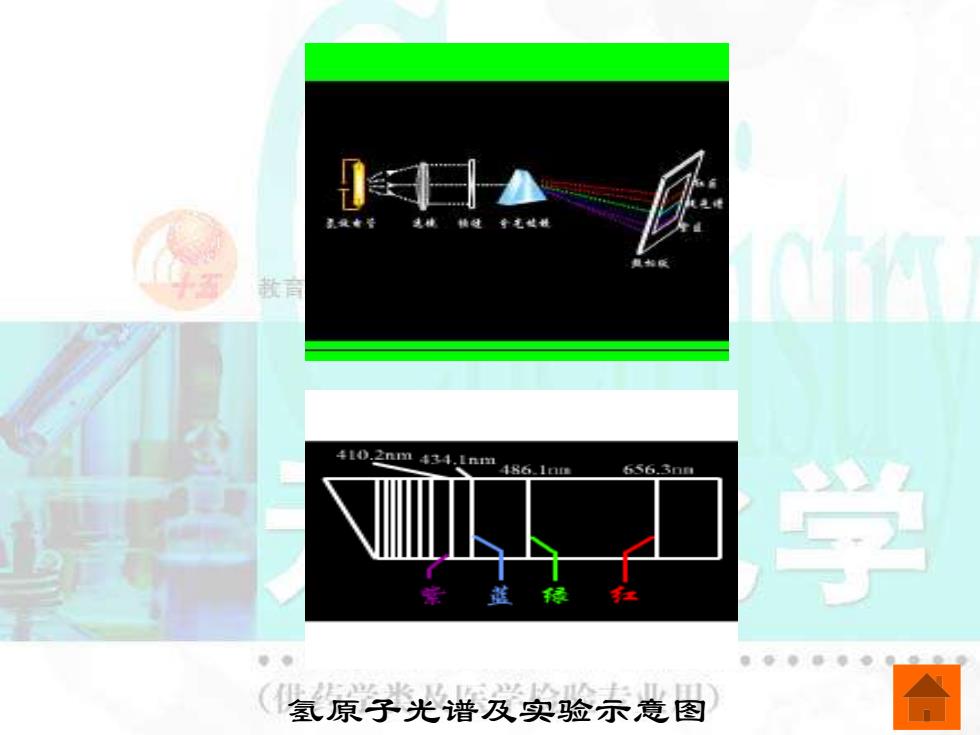
410.2nm434.1nm4861nm 656.3mm 学 氢原子光谱及实验茶意图
氢原子光谱及实验示意图

1913年,瑞典物理学家里德伯总结出适用氢 原子光谱的谱线频率的通式: o=R( 11 1n2 n G为波数, o=1/λ=v/c;1 。为里德伯常数, R=1.097×107m1;n1和n2为正整数,n2>n1o 在某一瞬间一个氢原子只能产生一条谱线, 实验中之所以能同时观察到全部谱线,是由于很 多个氢原子受到激发,跃迁到高能级后又返回低 能级的结果。 (供药学类及医学检验专业用)
1913 年,瑞典物理学家里德伯总结出适用氢 原子光谱的谱线频率的通式: σ为波数, ; 为里德伯常数, ;n1 和 n2 为正整数,n2 > n1。 在某一瞬间一个氢原子只能产生一条谱线, 实验中之所以能同时观察到全部谱线,是由于很 多个氢原子受到激发,跃迁到高能级后又返回低 能级的结果。 2 2 1 2 1 1 R ( ) n n = − = = 1/ / v c R 7 1 R 1.097 10 m− =

二、玻尔理论 玻尔的原子结构模型的基本要点如下: (1)电子只能在某些特定的圆形轨道上绕核 运动,在这些轨道上运动的电子既不放出能量, 也不吸收能量。学“十五国家规划课题牙究成果 (2)电子在不同轨道上运动时,它的能量是 不同的。电子在离核越远的轨道上运动时,其能 量越高;在离核越近的轨道上运动时,其能量越 低。轨道的这些不同的能量状态称为能级,其中 能量最低的状态称为基态,其余能量高于基态的 状态称为激发态。原子轨道的能量是量子化的 氢原子轨道的能量为: E=-13.6eV. (供药学类及医心检验专业用
二、玻尔理论 玻尔的原子结构模型的基本要点如下: (1)电子只能在某些特定的圆形轨道上绕核 运动,在这些轨道上运动的电子既不放出能量, 也不吸收能量。 (2)电子在不同轨道上运动时,它的能量是 不同的。电子在离核越远的轨道上运动时,其能 量越高;在离核越近的轨道上运动时,其能量越 低。轨道的这些不同的能量状态称为能级,其中 能量最低的状态称为基态,其余能量高于基态的 状态称为激发态。原子轨道的能量是量子化的, 氢原子轨道的能量为: 2 13.6 E n eV n − =

(3)当电子在能量不同的轨道之间跃迁时, 原子就会吸收能量或放出能量。当电子从能量较 高的轨道跃迁到能量较低的轨道时,原子以光的 形式释放出能量,释放出光的频率与轨道能量间 的关系为:育科学十五 国家规课晒研究成果 E2-E V= h 无机化学 (供药学类及医学检验专业用)
(3)当电子在能量不同的轨道之间跃迁时, 原子就会吸收能量或放出能量。当电子从能量较 高的轨道跃迁到能量较低的轨道时,原子以光的 形式释放出能量,释放出光的频率与轨道能量间 的关系为: E E 2 1 v h − =

玻尔理论成功地解释了原子稳定存在的事实 和氢原子光谱。 在正常状态时,核外电子处于最低的基态, 在该状态下运动的电子既不吸收能量,也不放出 能量,电子的能量不会减少,因此不会落到原子 核上,原子不会毁灭。 当原子从外界接受能量时,电子就会跃迁到 能量较高的激发态。而处于激发态的电子是不稳 定的,它会跃迁回能量较低的轨道,同时将能量 以光的形式发射出来,发射出的光的频率决定于 跃迁前后两个轨道间的能量美。由于轨道的能量 是不连续的,发射出的光的频率也是不连续的, 因此得到的氢原子光谱是线状光谱
玻尔理论成功地解释了原子稳定存在的事实 和氢原子光谱。 在正常状态时,核外电子处于最低的基态, 在该状态下运动的电子既不吸收能量,也不放出 能量,电子的能量不会减少,因此不会落到原子 核上,原子不会毁灭。 当原子从外界接受能量时,电子就会跃迁到 能量较高的激发态。而处于激发态的电子是不稳 定的,它会跃迁回能量较低的轨道,同时将能量 以光的形式发射出来,发射出的光的频率决定于 跃迁前后两个轨道间的能量差。由于轨道的能量 是不连续的,发射出的光的频率也是不连续的, 因此得到的氢原子光谱是线状光谱