
第十七章 ds区元素 第一节 铜族元素 第二节 锌族元素
第十七章 ds区元素 第一节 铜族元素 第二节 锌族元素

第一节 铜族元素 一、 铜族元素概述 二、 铜的重要化合物 三、 银的重要化合物 GOLD a99.9 四
第一节 铜族元素 一、铜族元素概述 二、铜的重要化合物 三、银的重要化合物

一、铜族元素概述 第11族元素包括钥、银、金三种元素,通常 称为铜族元素。 (一)钥族元素的通性 铜族元素的外层电子组态为(n-1)d10nsl。由于 18电子层组态对原子核的屏蔽效应比8电子层组态 要小,因此钥族元素原子作用在最外层电子上的有 效核电荷较多,最外层的$电子受原子核的吸引比 碱金属元素原子要强得多,所以钥族元素的电离能 比同周期碱金属元素显著增大,原子半径也显著减 小,铜族元素单质的化学性质远不如相应的碱金属 元素的单质活泼
无机化学 一、铜族元素概述 (一) 铜族元素的通性 铜族元素的外层电子组态为 (n-1)d10ns 1。由于 18电子层组态对原子核的屏蔽效应比8电子层组态 要小,因此铜族元素原子作用在最外层电子上的有 效核电荷较多,最外层的 s 电子受原子核的吸引比 碱金属元素原子要强得多,所以铜族元素的电离能 比同周期碱金属元素显著增大,原子半径也显著减 小,铜族元素单质的化学性质远不如相应的碱金属 元素的单质活泼。 第 11 族元素包括铜、银、金三种元素,通常 称为铜族元素
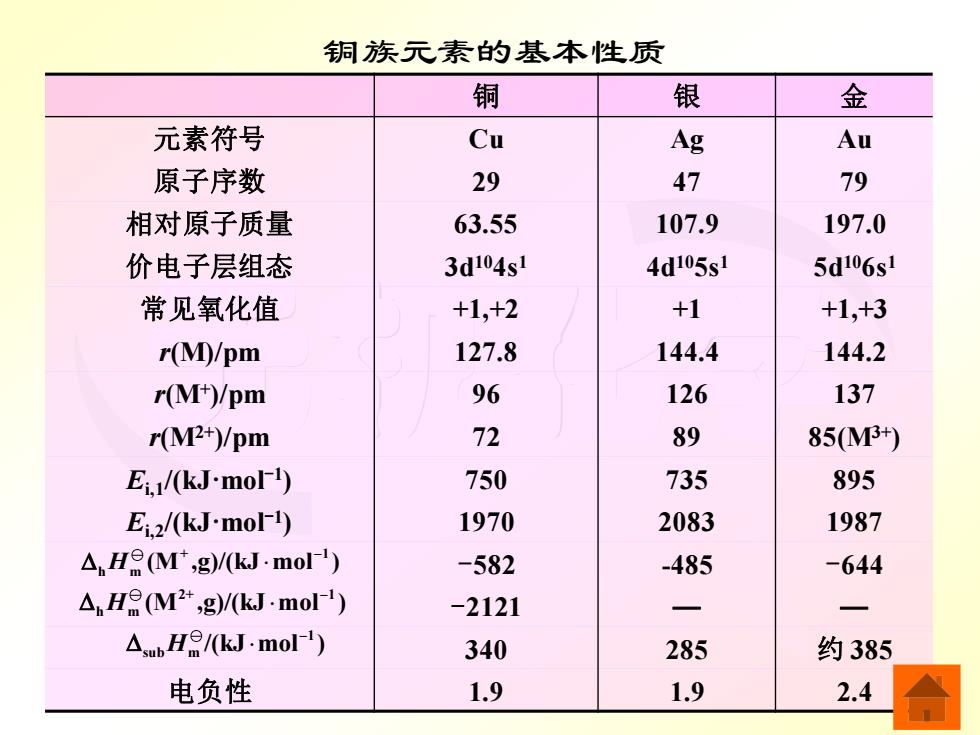
铜族元素的基本性质 铜 银 金 元素符号 Cu Ag Au 原子序数 29 47 79 相对原子质量 63.55 107.9 197.0 价电子层组态 3d104s1 4d105s1 5d106s1 常见氧化值 +1,+2 +1 +1,+3 r(M)/pm 127.8 144.4 144.2 r(M-)/pm 96 126 137 r(M2+)/pm 72 89 85M+) Ei./(kJ-mol1) 750 735 895 Ei2/(kJ-moF1) 1970 2083 1987 △HeM,g)/k·mol) -582 -485 -644 △.HeM2+,g/kJ·mol) -2121 一 一 △He/kJ·mol) 340 285 约385 电负性 1.9 1.9 2.4
无机化学 铜族元素的基本性质 铜 银 金 元素符号 Cu Ag Au 原子序数 29 47 79 相对原子质量 63.55 107.9 197.0 价电子层组态 3d104s1 4d105s1 5d106s1 常见氧化值 +1,+2 +1 +1,+3 r(M)/pm 127.8 144.4 144.2 r(M+ )/pm 96 126 137 r(M2+)/pm 72 89 85(M3+) Ei,1/(kJ·mol-1 ) 750 735 895 Ei,2/(kJ·mol-1 ) 1970 2083 1987 -582 -485 -644 -2121 ─ ─ 340 285 约 385 电负性 1.9 1.9 2.4 + 1 h m (M ,g)/(kJ mol ) − H 2+ 1 h m (M ,g)/(kJ mol ) − H 1 sub m /(kJ mol ) − H

铜族元素的氧化值有+1、十2、+3,这是由于 钥族元素原子的最外层S电子的能量与外次层d电 子的能量相差较小,在反应中不仅能失去S电子, 在一定条件下还可以失去一个或两个次外层的d电 子。 钥族元素离子具有18电子组态或9~17电子组 态,具有较强的极化力和明显的变形性,所以本族 元素容易形成共价化合物。本族元素离子形成配合 物的倾向也很显著。 铜族元素单质在水溶液中较不活泼,金属活泼 性按铜、银、金的顺序降低。 在酸性溶液中,Cu和Au均不稳定,容易发 生歧化反应
无机化学 铜族元素的氧化值有 +1、+2、+3,这是由于 铜族元素原子的最外层 s 电子的能量与外次层 d 电 子的能量相差较小,在反应中不仅能失去s 电子, 在一定条件下还可以失去一个或两个次外层的 d 电 子。 铜族元素离子具有 18 电子组态或 9~17 电子组 态,具有较强的极化力和明显的变形性,所以本族 元素容易形成共价化合物。本族元素离子形成配合 物的倾向也很显著。 铜族元素单质在水溶液中较不活泼,金属活泼 性按铜、银、金的顺序降低。 在酸性溶液中,Cu+ 和 Au+ 均不稳定,容易发 生歧化反应