
第十四章p区元素(二) 第一节氧族元素 第二节 卤族元素 第三节 稀有气体
第十四章 p 区元素(二) 第一节 氧族元素 第二节 卤族元素 第三节 稀有气体

第一节氧族元素 第16族元素也称氧族元素,由氧、硫、硒、 碲和钋五种元素组成。氧和硫元素是典型的非金属 元素,硒和啼元素是准金属元素,钋元素是放射性 金属元素
第一节 氧族元素 第 16 族元素也称氧族元素,由氧、硫、硒、 碲和钋五种元素组成。氧和硫元素是典型的非金属 元素,硒和碲元素是准金属元素,钋元素是放射性 金属元素

氧是地壳中分布最广的元素,其丰度居各种元 素之首。氧广泛分布在大气和海洋中,在海洋中主 要以水的形式存在:在大气层中,氧以单质状态存 在0 硫在自然界中的含量较少,主要以硫化物和硫 酸盐的形式存在。 硒和碲属于分散稀有元素,常以硒化物和碲化 物的形式存在于各种硫化物矿中
无机化学 氧是地壳中分布最广的元素,其丰度居各种元 素之首。氧广泛分布在大气和海洋中,在海洋中主 要以水的形式存在;在大气层中,氧以单质状态存 在。 硫在自然界中的含量较少,主要以硫化物和硫 酸盐的形式存在。 硒和碲属于分散稀有元素,常以硒化物和碲化 物的形式存在于各种硫化物矿中
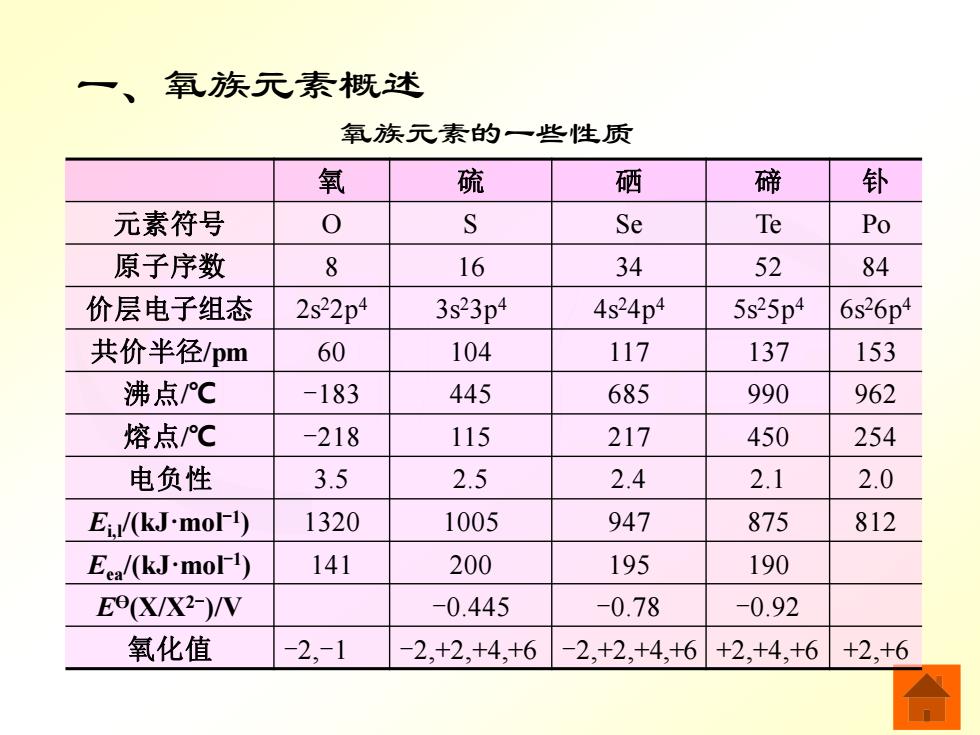
一、氧族元素概述 氧族元素的一些性质 氧 硫 硒 碲 钋 元素符号 0 S Se Te Po 原子序数 P 16 34 52 84 价层电子组态 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4 共价半径/pm 60 104 117 137 153 沸点℃ -183 445 685 990 962 熔点℃ -218 115 217 450 254 电负性 3.5 2.5 2.4 2.1 2.0 Ei/(kJ-mol-1) 1320 1005 947 875 812 Ea/(kJ-mol1) 141 200 195 190 E0X/X2-)/W -0.445 -0.78 -0.92 氧化值 -2,-1 -2.+2.+4.+6-2,+2,+4,+6 +2,+4,+6 +2,+6
无机化学 一、氧族元素概述 氧族元素的一些性质 氧 硫 硒 碲 钋 元素符号 O S Se Te Po 原子序数 8 16 34 52 84 价层电子组态 2s22p4 3s23p4 4s24p4 5s25p4 6s26p4 共价半径/pm 60 104 117 137 153 沸点/℃ -183 445 685 990 962 熔点/℃ -218 115 217 450 254 电负性 3.5 2.5 2.4 2.1 2.0 Ei,l/(kJ·mol-1 ) 1320 1005 947 875 812 Eea/(kJ·mol-1 ) 141 200 195 190 EӨ(X/X2- )/V -0.445 -0.78 -0.92 氧化值 -2,-1 -2,+2,+4,+6 -2,+2,+4,+6 +2,+4,+6 +2,+6

从氧到钋随着原子序数的增大,元素的原子 半径依次增大,元素的电负性、电离能和电子亲 和能依次减小,元素的非金属性依次减弱,金属 性逐渐增强。 氧族元素的价电子层组态为nsnp4,有夺取 或共用两个电子达到稀有气体原子电子层组态的 倾向,表现出较强的非金属性。 氧元素的电负性很大,仅次于氟元素,因此 氧元素在大多数含氧化合物中的氧化值为一2。 硫、硒、碲的价电子层中均有空d轨道,当 与电负性比较大的元素化合时,空d轨道也可以 成键,这些元素的氧化值可呈现十2、十4、+6。 氧族元素具有较强的配位能力,O和S是常 见的配位原子
无机化学 从氧到钋随着原子序数的增大,元素的原子 半径依次增大,元素的电负性、电离能和电子亲 和能依次减小,元素的非金属性依次减弱,金属 性逐渐增强。 氧族元素的价电子层组态为 ns 2np 4,有夺取 或共用两个电子达到稀有气体原子电子层组态的 倾向,表现出较强的非金属性。 氧元素的电负性很大,仅次于氟元素,因此 氧元素在大多数含氧化合物中的氧化值为-2。 硫、硒、碲的价电子层中均有空 d 轨道,当 与电负性比较大的元素化合时,空 d 轨道也可以 成键,这些元素的氧化值可呈现 +2、+4、+6。 氧族元素具有较强的配位能力,O 和 S 是常 见的配位原子