
CH一CH一CH一CH,一CH-CH叫2-甲基4Z基己烷 CH CH, CH 这里值得指出,在英文命名中是按照取代基英文名称的第一个字母的顺序来命名的。甲 基(methyl)的第一个字母是m,乙基(ethyl)的第一个字母是e,所以乙基应在甲基前面,故上 例就叫4-ethyl-2-methylhexane。. ①如有等长的碳链均可作为主链时,应选择取代基最多的为主链。例如: CH-CH-CH-CH,-CH 川2,4-二甲基-3乙基已烷 CH.4CH-CH, 5CHz 6CH 复杂取代基的编号由与主链相连的碳原子开始。例理: 11CH3 CH (H CH-CH.-CH CH-CH.-CH.-CH-CH-CH ICH: CH: 2CH-CHs 3'(H 叫27,少三甲基-6(2甲#丙#)十-烷,或叫2.7.9-三甲持异打基十-一烷 2.3烷烃的结构 2.3.1碳原子的正四面体构型和p杂化 前面所写的化合物的构造式只能告诉我们分子中原了之间的连接方式或次序。例如甲烷 的构造式只能说明分子中有四个氢与碳直接相连,而没有表示出氢原子与碳原子在空间的排 列方式,也就是不能说明分子的立体形状。1874年范特荷夫(Vn'1Hoff)根据大量的实验事 实,提出碳原子的正四面体的概念。他认为与碳原子相连的四个原子或原子团在正四面体的 四个顶点上。由中心碳原了向四个顶点所作的连线就是碳的四个价键的分布方向。甲烷分子 的构型是正四面体。现代物理方法如电子衍射也证明了这一点。四个C-一H键完全相同,键 长是109pm.键角为109°28, 为了帮助人们更好地了解分子的立体形状,通常用克勒(Kku'e)模型(或叫球棒模型) 和斯陶特(Stuart)模型(或叫比例模型)来表示,如图2.1所示。 克库勒模型是用不同颜色的小球代表各种原子,用短棒表示化学键。克库勒分子模型有 立体形象,易于观察,使用方便,只是不能准确地表示出原子的大小和键长。斯陶特模型是根 26

据分子中各原子的大小和键长的真实比例放大(2亿:1)制成的分子模型,它比较符合分子的 形状 正四体构型 克库物模 特模型 图2】甲烷的分子模型 有机化合物都可以用分子模型来表示分子中各原子的空间排列状况,即所谓构型(Co figuration)是指具有一定构造的分子中原子在空间的排列状况。我们学习有机化学时应该十 分注意有机化合物的立体概念 前面我们提到甲烷中碳原子是4价的,而且四个(一H键完全等同,甲烷分子是正四面体 构型,那么我们应如何来解释这些实验事实呢? 碳原子在基态的电子构型是12,2,2:,2公,有两个未成对的电子。所以碳原子应该表 现为2价,然而实际上碳在几乎所有的有机化合物中都是4价,而不是2价的。这说明在碳原 千与其他原子结合时必然有一个2:电子获得一定能量“提升”到2轨道上去,即从碳原子的 基态妖迁到激发态,所形成的碳原子可以说是处于激发的(或活化的)状态。这样碳原子就形 成4价。键的形成是一个释放能量的过程,现在碳多形成两个键所释放出来的能量足以补偿 激发一个电子所需的能量而有余。所以在成键时碳原子是4价的,形成的分子更稳定,如图 2.2所示。可是在这四个单电子分别所处的四个原子轨道中有一个是s轨道,三个是力轨道, 它们不仅在空间伸展方向不同,而且能量也有差别。这样它们与四个氢的1s轨道所形成的共 2y2p,r2p,' 2s7(2p,2p12pJ 能雕很小 4p3 约401.7-0mot -2'2p 图2.2碳原子激发为再形成止四面体产物的能量变化示意图
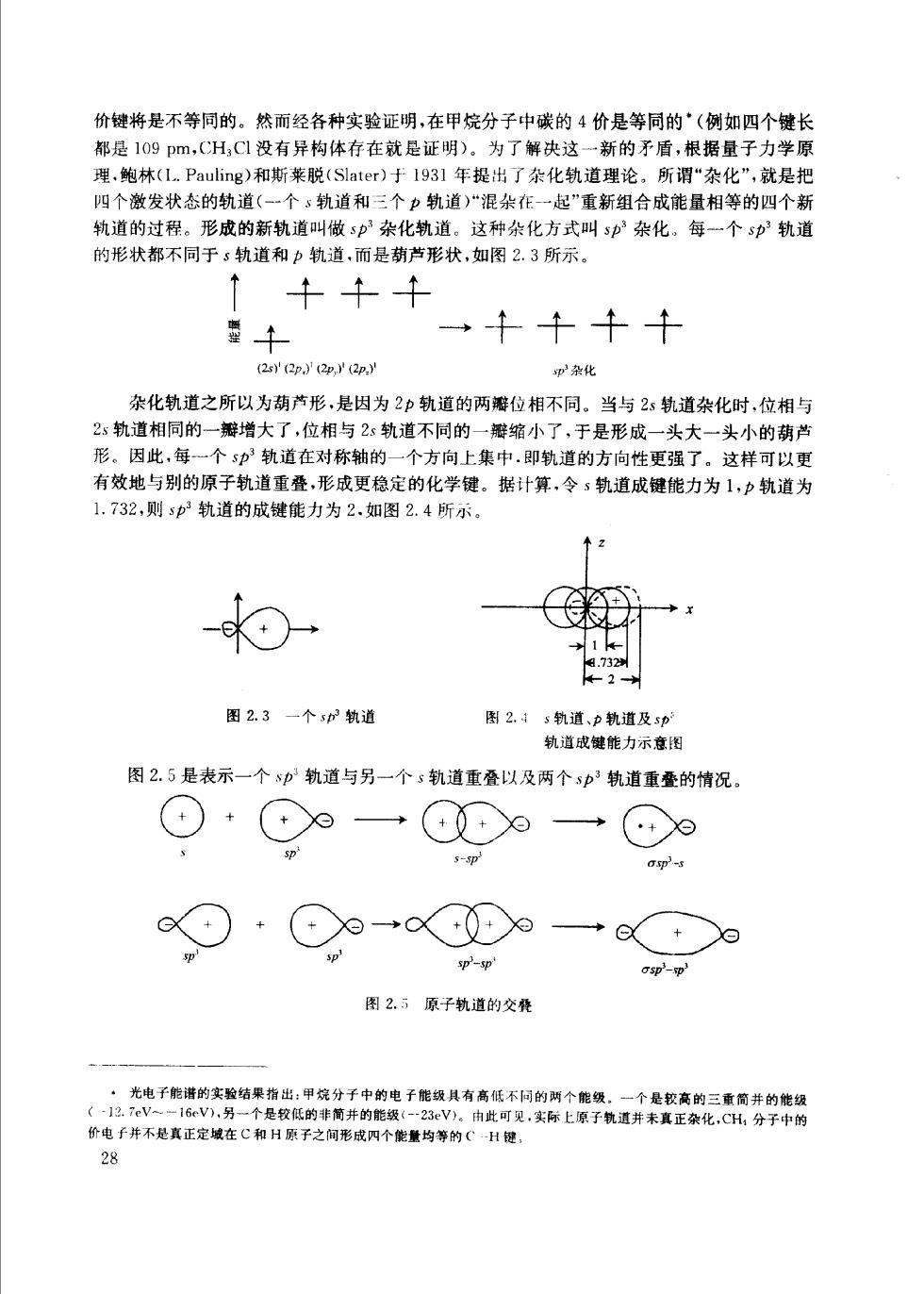
价键将是不等同的。然而经各种实验证明,在甲烷分子中碳的4价是等同的'(例如四个键长 都是109pm,CH,C1没有异构体存在就是证明)。为了解决这一新的矛盾,根据量子力学原 理.鲍林(1.Pauling)和斯莱脱(Slater)于193l年提出了杂化轨道理论。所谓“杂化”,就是把 四个激发状态的轨道(-一个、轨道和三个力轨道)“混杂作一起”重新组合成能量相等的四个新 轨道的过程。形成的新轨道叫做sp杂化轨道。这种杂化方式叫sp杂化。每一个sp轨道 的形状都不同于5轨道和中轨道,而是葫芦形状,如图2.3所示。 一千千十 甲杂化 杂化轨道之所以为葫芦形,是因为2p轨道的两瓣位相不同。当与2s轨道杂化时,位相与 2轨道相同的一瓣增大了,位相与2:轨道不同的一瓣缩小了,于是形成一头大一头小的葫芦 形。因此每一个5p轨道在对称轴的 一个方向上集中.即轨道的方向性更强了。这样可以更 有效地与别的原子轨道重叠,形成更稳定的化学键。据计算,令s轨道成键能力为1,力轨道为 1.732,则sp轨道的成键能力为2.如图2.4所示 - 图2.3一个s轨道 图24s轨道、户轨道及5 轨道成键能力示意国 图2.5是表示一个中轨道与另一个s轨道重叠以及两个3p3轨道重叠的情况 ⊙+9一议9一9 s- sp-sp asp'-sp 图2.5原子轨道的交得 (一子的实结果烧分千中的电能酸有任不的两个能经,。个是软离的三商并的能级 用 价电子并不是真正定城在C和】 原子之间形成个能量均等的( 什是乳实称上原子镜道并未真正杂化,G分竿作钢 28
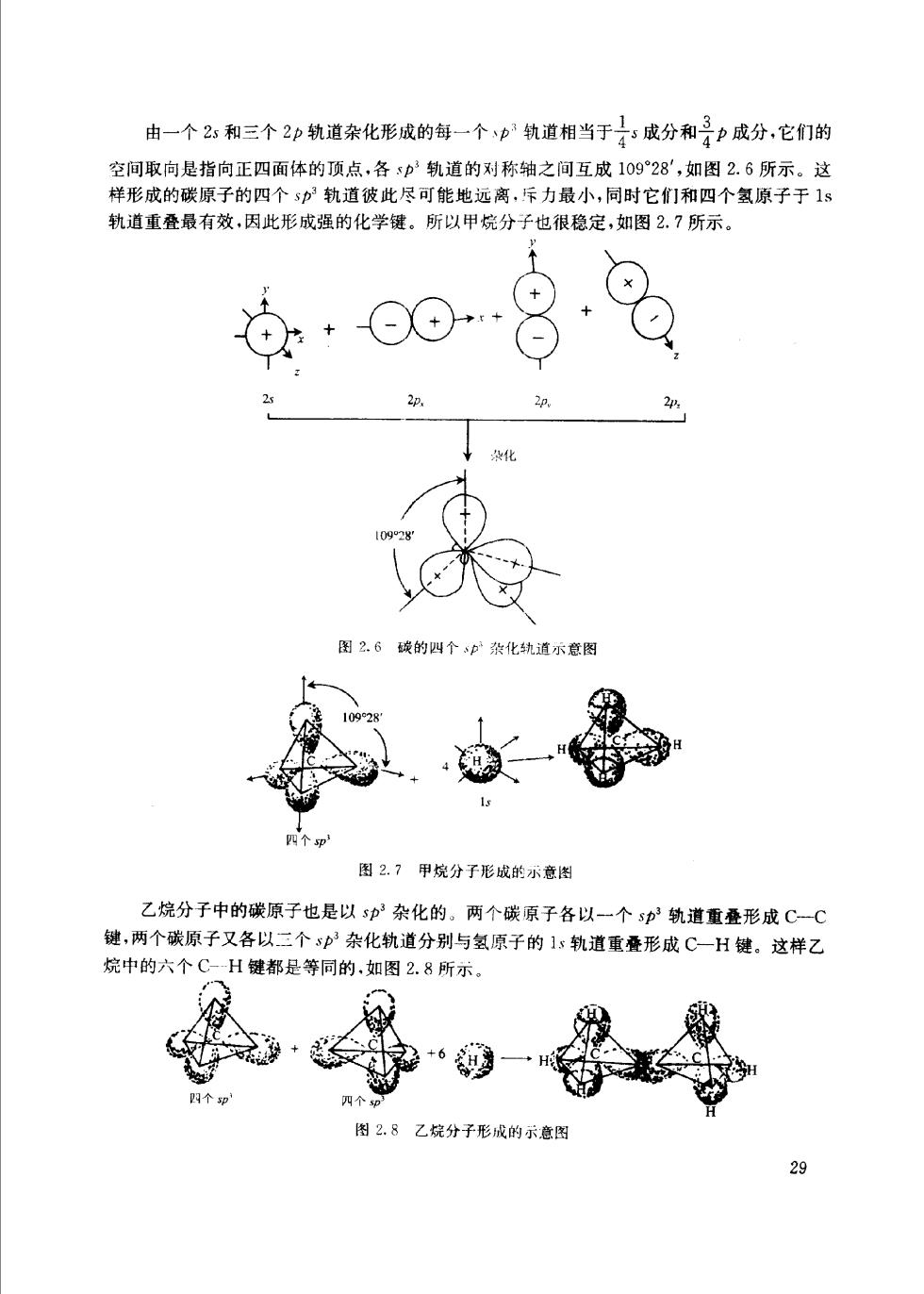
由一个2:和三个2印轨道杂化形成的每一个p轨道相当于子成分和子力成分,它们的 空间取向是指向正四面体的顶点,各p轨道的对称轴之间互成10928,如图2.6所示。这 样形成的碳原子的四个s分轨道彼此尽可能地远离,斥力最小,同时它们和四个氢原子于1s 轨道重叠最有效,因此形成强的化学键。所以甲烷分子也很稳定,如图2.7所示。 图26统的四个中化轨道示意图 薄一 图2.7甲烷分子形成能示意出 乙烷分子中的碳原子也是以sp杂化的。两个碳原子各以一个s中轨道重叠形成C一C 键,两个碳原子又各以二个sp杂化轨道分别与氢原子的1:轨道重叠形成C一H键。这样乙 烷中的六个C-H键都是等同的,如图2.8所示。 图28乙烷分子形成的示意图

可见乙烷分子的形状是由两个四面体共用一个顶角组成的。丙烷、丁烷等分子的形状类似 在烷烃分子中,碳原子都是采取s杂化的。C-C键为sp一5p,C一H键为sp一5 它们成键原子的电子云都是沿键轴近似于圆柱形对称分布,成键的两个原子通常可以围绕着 键轴自由旋转,我们把这样的键称为。键。 中出于碳的价键分布呈正四面体型,键角为10928',再加上C一C键可以自由旋转,因此烷 经分子中的碳键并不是直线型的,可以形成多种曲折形式,如图2.9所示。 88 图29正烷碳链运动的几种形式 图2.10戊烧分子模型 但是在固态时,烷烃的碳链排列整齐,呈锯齿状。戌烷分子模型如图2.10所示。为方便 起见,一般用构造式和简式表示分子结构。戊烷的构造式为: HH HH H 简式为:CHCH,CHCH.CH,或入人. 2.3.2烷烃的构象 刚才我们讨论过烷烃分子中的碳原子可以绕C-(键进行自由旋转,这就使得一个碳原 F上的个氢原子与另一个碳上的氢原子在空间的相对位置发生变化,产生不同形象的分子 」.乙烷的构象 乙烷分子的形状可以用“双三脚架”来比喻。六个H是六个脚底,C一C键连着两个三脚 由于CC单键可以自由旋转,所以这三个脚像电风扇一样可以自由转动。为了便于观察,使 个甲基固定不动,另一个甲基绕CC建轴旋转,则分子中氢原子在空间的排列形式将不断 改变而有无数种。这种由于原子或原子闭绕单键旋转而产生的分子中各原子或原子团的不同 的空间排布,叫做构象(conformation)。乙烷分子最典型的两种构象是交叉式(staggered)和 重叠式(eclipsed)。可用三种最常使用的投影式表示如下: (i)交叉式构象 -人才-女