
山东理工大客S 9.7电动势测定的应用SHANDONGUNIVERSITYOFTECHNOLOGY③2H,0(g) = 2H2(g) + O2(g)2α2(1-α)En;=2+αα其中α为离解度Av001pKe= K= K5.97×1081An!1EnpZnpQ3QsV(1-α)(2 +α)2α=2.5 X 10-27
6 2(1-) 2 ni=2+ 其中为离解度 =2.5×10-27 = = np p K np p K Kn n 81 5.97 10 1 = ③ 2H2O(g) = 2H2 (g) + O2 (g) (1 ) (2 ) 2 3 − + = 2 3 §9.7 电动势测定的应用
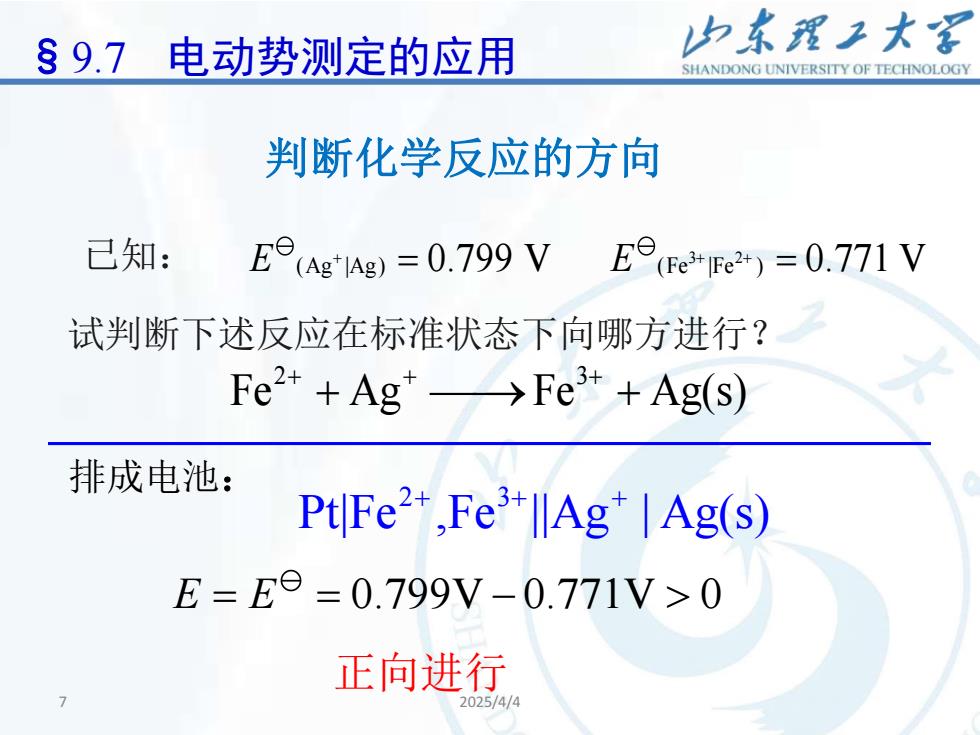
山东理工大客S 9.7电动势测定的应用SHANDONGUNIVERSITYOFTECHNOLOGY判断化学反应的方向已知:E(Ag*lAg) = 0.799 VE(Fe (Fet) = 0.771 V试判断下述反应在标准状态下向哪方进行?Fe2+ + Ag*>Fe3+ + Ag(s)排成电池:Pt|Fe2+,Fe3+IAg+ |Ag(s)E = E = 0.799V-0.771V> 0正向进行2025/4/4
7 2025/4/4 7 已知: 3 2 E E (Ag |Ag) (Fe |Fe ) + + + = = 0.799 V 0.771 V 试判断下述反应在标准状态下向哪方进行? 2 3 Fe Ag Fe Ag(s) + + + + ⎯⎯→ + 排成电池: 2 3 Pt|Fe ,Fe ||Ag | Ag(s) + + + 正向进行 E E = = − 0.799V 0.771V 0 判断化学反应的方向 §9.7 电动势测定的应用

山东理工大客8 9.7电动势测定的应用SHANDONGUNIVERSITYOFTECHNOLOGY判断化学反应的方向P(Ox/Rea)越低(负)→越易失去电子;P(Ox/Red)越高(正)→越易得到电子所以P(ox /Rea)低的金属能从溶液中置换出P(ox/Red)高的金属K Ca Na Mg Al Zn Fe Sn Pb H, Cu Hg Ag Pt Au
8 (Ox /Red)越低(负)→越易失去电子; (Ox /Red)越高(正)→越易得到电子, 所以 (Ox /Red)低的金属能从溶液中置换出 (Ox /Red)高的 金属 K Ca Na Mg Al Zn Fe Sn Pb H2 Cu Hg Ag Pt Au 判断化学反应的方向 §9.7 电动势测定的应用

山东理工大客S 9.7电动势测定的应用SHANDONGUNIVERSITYOFTECHNOLOGY例:25℃有溶液a(Sn2+)=1.0,a(Pb2+)=1.0②a(Sn2+)=1.0, a(Pb2+)=0.1,问Pb能否置换Sn解:查表得:pe (Sn/Sn2+) = - 0.136V,pe (Pb/Pb2+) = - 0.126V①a(Sn2+) = a(Pb2+), e (Sn/Sn2+) < pe (Pb/Pb2+)..Pb不能置换Snp(Pb/Pb2+) > Φ(Sn/Sn2+)②p(Sn /Sn2+) = pe (Sn /Sn2+)p(Pb/Pb2+)= - 0.126+0.02855 Ig 0.1= - 0.156V< Φ(Sn/Sn2+)Pb可以置换Sn
9 解:查表得: y (Sn/Sn2+) = – 0.136V, y (Pb/Pb2+) = – 0.126V ②a(Sn2+)=1.0,a(Pb2+)=0.1, 问Pb能否置换Sn 例:25℃有溶液①a(Sn2+)=1.0,a(Pb2+)=1.0 ②(Sn /Sn2+) = y (Sn /Sn2+) (Pb/Pb2+)= − 0.126+0.02855 lg 0.1 = − 0.156V< (Sn/Sn2+) Pb可以置换Sn ①a(Sn2+) = a(Pb2+),y (Sn/Sn2+) < y (Pb/Pb2+) (Pb/Pb2+) > (Sn/Sn2+) Pb不能置换Sn §9.7 电动势测定的应用

山东理工大客S 9.7电动势测定的应用SHANDONGUNIVERSITYOFTECHNOLOGY确定离子价态例 18℃时,电池 Hg()I Hg,n+(mi)II Hgn"+(m2)|Hg(l)的E=0.0290V,已知m,/m,=10,溶液离子强度相等.确定亚汞离子以Hg+或Hg22+形态存在解: (-) nHg()- ne→Hg,n+(mi)(+) Hg,n+(m) + ne → nHg(l电池反应 Hgnn+(m2)→Hgnn+(mi)RTRTazY±,2m20.0577E=Inn= 0.0290nFnFajI+,1min(离子强度相等,则+相等,故aj/az=mj/m2=10)n = 1.99 ~ 2所以亚汞离子以Hg,2+形态存在
10 例 18℃时,电池 Hg(l)| Hgn n+ (m1 )|| Hgn n+ (m2 )|Hg(l) 的E=0.0290V,已知m1 /m2=10,溶液离子强度相等.确 定亚汞离子以Hg+或Hg2 2+形态存在。 解:( –) nHg(l) – ne→Hgn n+ (m1 ) ( +) Hgn n+ (m2 ) + ne → nHg(l) (离子强度相等,则相等,故a1 /a2 = m1 /m2=10) n = 1.99 2 所以亚汞离子以Hg2 2+形态存在。 电池反应 Hgn n+(m2 )→Hgn n+(m1 ) 1 2 ln a a nF RT E = ,1 1 ,2 2 ln m m nF RT = 0.0290 0.0577 = = n §9.7 电动势测定的应用 确定离子价态