
第7章氧化还原滴定法7.1氧化还原平衡7.2氧化还原滴定原理7.3氧化还原滴定中的预处理7.4常用的氧化还原滴定法7.5氧化还原滴定结果的计算
1 7.1 氧化还原平衡 7.2 氧化还原滴定原理 7.3 氧化还原滴定中的预处理 7.4 常用的氧化还原滴定法 7.5 氧化还原滴定结果的计算 第7章 氧化还原滴定法

不做考试大纲要求的内容课本7.1.4化学计量点时反应进行的程度7.2.3氧化还原滴定终点误差7.4.4其他氧化还原滴定法智慧树在线课(知到app)5.7氧化还原滴定终点误差5.13氧化还原滴定法的方法—一其他方法山东翟工大2HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 7.1.4 化学计量点时反应进行的程度 7.2.3 氧化还原滴定终点误差 7.4.4 其他氧化还原滴定法 2 不做考试大纲要求的内容 课本 智慧树在线课(知到app) 5.7 氧化还原滴定终点误差 5.13 氧化还原滴定法的方法——其他方法

7.1氧化还原平衡7.1.1概述氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的来表示。电极电势例电对半反应电极电势氧化还原电对Ce4+ +e' =Ce3+PO, /R,Oi +ze =Ri6= 1.61VDFe3+ +e' =- Fe?+O2 /R2O2 +z2e =RP2β°= 0.777V如果,>,有氧化还原反应z,O, +z,R, = z,R, +z,O,03+Ce4+ + Fe2+ = Ce3+ + Fe山东翟工大室3SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry O1 R1 氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的 电极电势 来表示。 电对半反应 电极电势 O R 1 1 1 z e 1 O R 2 2 2 z e 2 z z z z 2 1 1 2 2 1 1 2 O R R O 3 2 F e e F e 例 0 777V θ . 4 3 C e e C e 1.61V 4 2 3 3 C e F e C e F e 氧化还原电对 O2 R 2 氧化还原平衡 概 述 3

能斯特方程回顾氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的电极电势来表示。可逆氧化还原电对的电极电势可用能斯特方程来表示O+ze- = R0.059VO(25℃)Φ=@1gRZ标准电势:当电对的氧化态[O|和还原态[R|的浓度为1mol/L时的电极电势。(附表15)山东理工大4HANDONGUNIVERSITYOFTECHNOLOGAnalyticalChemistry
Analytical Chemistry 4 氧化剂或还原剂的氧化或还原能力的强弱可以用有关电对的电 极电势 来表示。 可逆氧化还原电对的电极电势可用能斯特方程来表示。 0.059 [O] lg (25 ) [R] V C z O R z e 标准电势φ ө : 当电对的氧化态[O]和还原态[R]的浓度为 1mol/L时的电极电势。(附表15) 能斯特方程回顾
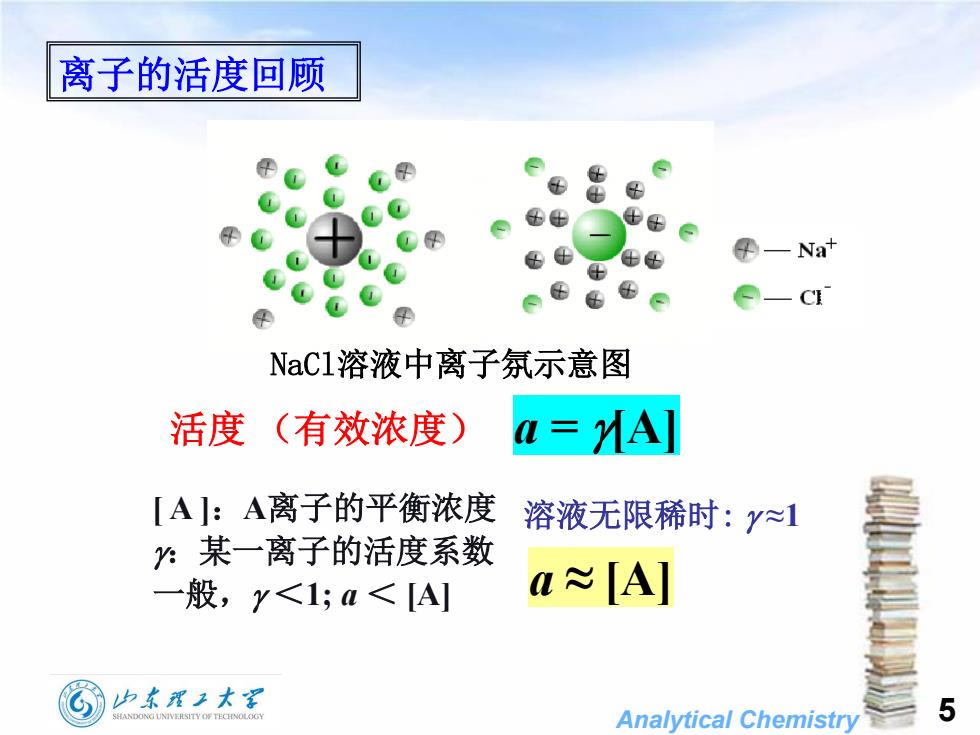
离子的活度回顾4F-NatH-CTNaC1溶液中离子氛示意图活度a= MA](有效浓度)【A]:A离子的平衡浓度溶液无限稀时:~1:某一离子的活度系数a~[A]一般,<1;a<[A]山东理工大5SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 活度 (有效浓度) [ A ]:A离子的平衡浓度 :某一离子的活度系数 一般, <1; a < [A] a = [A] 溶液无限稀时: ≈1 NaCl溶液中离子氛示意图 a ≈ [A] 5 离子的活度回顾