
二、 过渡状态理论 过渡状态理论认为:化学反应并不是通过 反应物分子的简单碰撞完成的,而是反应物分 子要经过一个中间过渡状态,形成活化配合物。 反应物与活化配合物之间很快达到化学平衡, 化学反应的反应速率由活化配合物的分解速率 决定。 反应过程可表示为: A+B-C=[A.B.C]^→A+B-C
二、过渡状态理论 过渡状态理论认为: 化学反应并不是通过 反应物分子的简单碰撞完成的,而是反应物分 子要经过一个中间过渡状态,形成活化配合物 反应物与活化配合物之间很快达到化学平衡, 化学反应的反应速率由活化配合物的分解速率 决定。 反应过程可表示为: = A+B C [A B C] A+B C ⎯→

在过渡状态理论中,活化能为活化配合物 的平均能量与反应物分子的平均能量的差值。 系统的摩尔热力学能变△Um等于产物的 平均能量(E2)与反应物的平均能量(E)的差值: △Um=E2-E, 近似认为△,Um≈△Hm,由上式可得: AHm=△,Um=E2一E=E*-E)-(E*-E,) A:Hm-EaEa
在过渡状态理论中,活化能为活化配合物 r m r m U H r m U r m 2 1 − U E E = 系统的摩尔热力学能变 等于产物的 的平均能量与反应物分子的平均能量的差值。 平均能量(E2)与反应物的平均能量(E1)的差值: 近似认为 ,由上式可得: ' r m a a H E E = - r m r m 2 1 1 2 H U E E E E E E = = = − = - =( - )( - )
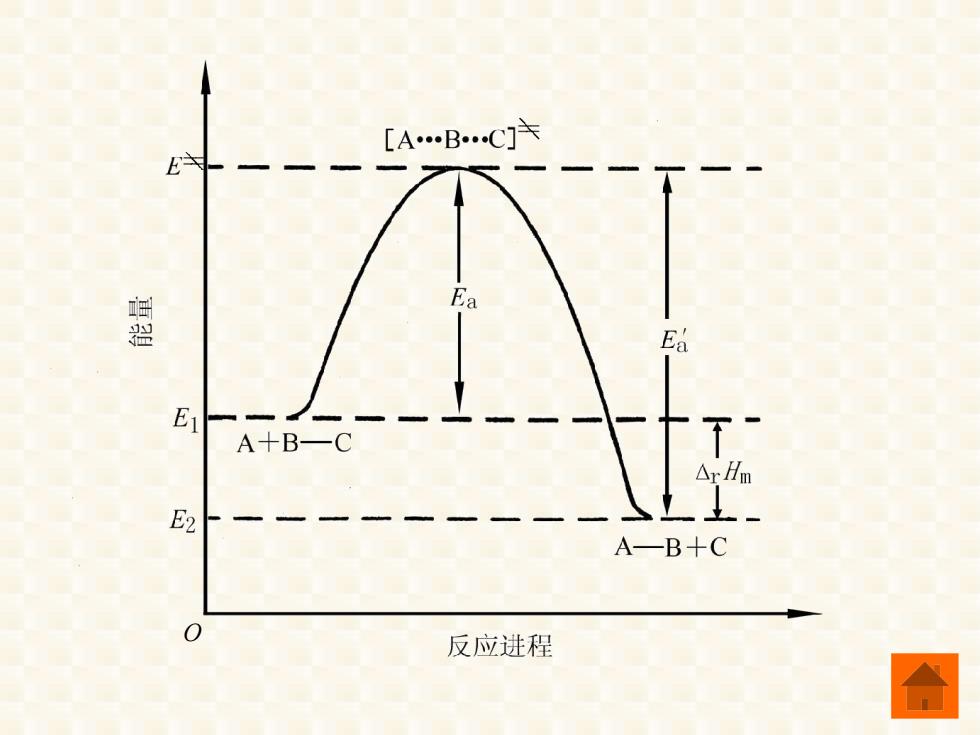
[A.B.CJ卡 E主 墨 Ea E1 A十B一C E2 A一B+C 反应进程
O

第三节浓度对化学反应速率的影响 一、元反应和复合反应 二、质量作用定律 三、反应级数和反应分子数 四、简单级数反应
第三节 浓度对化学反应速率的影响 一、元反应和复合反应 二、质量作用定律 三、反应级数和反应分子数 四、简单级数反应

一、元反应和复合反应 反应物的微粒(分子、原子、离子或自由 基)间直接碰撞而一步实现的化学反应,称为 元反应。大多数化学反应要经过若干个步骤, 即经过若干个元反应才能完成,这类反应称为 复合反应。在复合反应中,各步反应的反应速 率通常并不相同,其中速率最慢的步骤决定了 总反应的反应速率。在复合反应中,速率最慢 的步骤称为复合反应的速率控制步骤
一、元反应和复合反应 反应物的微粒(分子、原子、离子或自由 基)间直接碰撞而一步实现的化学反应,称为 元反应。大多数化学反应要经过若干个步骤, 即经过若干个元反应才能完成,这类反应称为 复合反应。在复合反应中,各步反应的反应速 率通常并不相同,其中速率最慢的步骤决定了 总反应的反应速率。在复合反应中,速率最慢 的步骤称为复合反应的速率控制步骤