
反应速率(rate of reaction) 1d5 y dt
1 d d r V t = 反应速率(rate of reaction)

化学反应速率 反应速率的符号 例如: R→P 反应物减少,产物增多,故而: dR]<0 dP],0 dt dt 但反应速率不能为负,故定义反应速率时是按照单位时间 反应物的减少或产物的增加来定义的 r=-d[R]_d[P >0 dt dt
化学反应速率 反应速率的符号 d[R] d[P] 0 0 d d t t d[R] d[P] = 0 d d r t t − = 例如: R P ⎯⎯→ 反应物减少,产物增多,故而: 但反应速率不能为负,故定义反应速率时是按照单位时间 反应物的减少或产物的增加来定义的
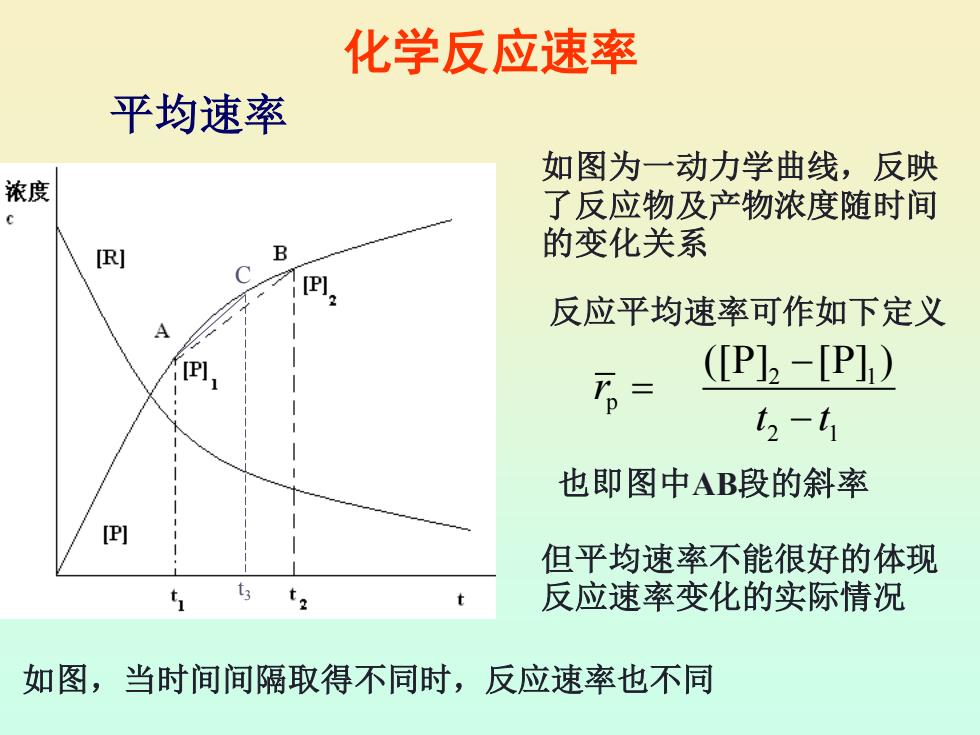
化学反应速率 平均速率 如图为一动力学曲线,反映 浓度 了反应物及产物浓度随时间 [R] B 的变化关系 [P] 反应平均速率可作如下定义 A [P] (P]2-[P]) t2-t1 也即图中AB段的斜率 [P] 但平均速率不能很好的体现 ti t 反应速率变化的实际情况 如图,当时间间隔取得不同时,反应速率也不同
化学反应速率 2 1 p 2 1 ([P] [P] ) r t t − = − 平均速率 如图为一动力学曲线,反映 了反应物及产物浓度随时间 的变化关系 反应平均速率可作如下定义 也即图中AB段的斜率 C t3 但平均速率不能很好的体现 反应速率变化的实际情况 如图,当时间间隔取得不同时,反应速率也不同
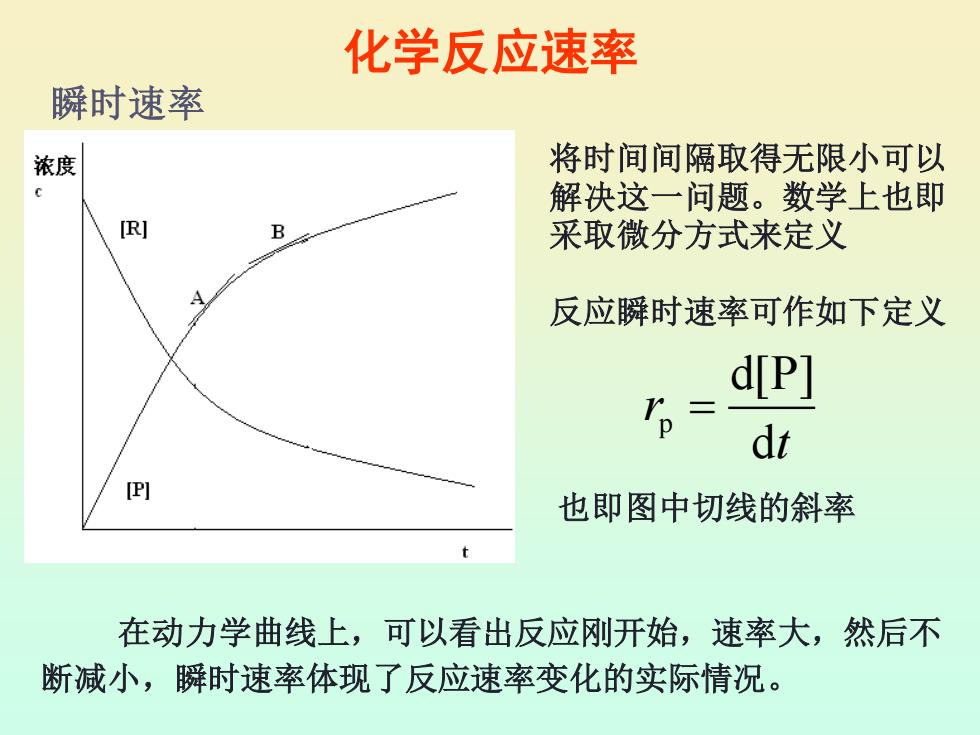
化学反应速率 瞬时速率 浓度 将时间间隔取得无限小可以 解决这一问题。数学上也即 [R] 采取微分方式来定义 反应瞬时速率可作如下定义 d[P] p= dt (P] 也即图中切线的斜率 在动力学曲线上,可以看出反应刚开始,速率大,然后不 断减小,瞬时速率体现了反应速率变化的实际情况
化学反应速率 p d[P] d r t = 在动力学曲线上,可以看出反应刚开始,速率大,然后不 断减小,瞬时速率体现了反应速率变化的实际情况。 瞬时速率 将时间间隔取得无限小可以 解决这一问题。数学上也即 采取微分方式来定义 反应瞬时速率可作如下定义 也即图中切线的斜率

化学反应速率 化学计量关系对反映速率的影响 N2+3H2→2NH3 时刻 [N2 [H2 [NH3] t+dt [N2]-d[N2][H2]-d[H2] [NH3]+d[NH3] 显然,dH2=3dN2] d[NH]=2d[N2] 对于N2: s、 d[N2] dt 对于H2:1 d(H2] 2三一 dt 对于NH3: d[NH;] 3=3r5=2所 dt
化学反应速率 2 2 3 N H NH + ⎯⎯→ 3 2 t时刻 [N2 ] [H2 ] [NH3 ] t+dt [N2 ]-d[N2 ] [H2 ]-d[H2 ] [NH3 ]+d[NH3 ] 显然,d[H2 ]=3d[N2 ] d[NH3 ]=2d[N2 ] 对于 N2: 2 1 d N[ ] r dt = − 对于 H2: 2 2 d H[ ] r dt = − 对于 NH3: 3 3 d NH [ ] r dt = 2 1 3 1 r r r r = = 3 2 化学计量关系对反映速率的影响