
活度系数y:对稀溶液m<0.1mol/kg或c<0.10mol/L时 ,用德拜-休克尔(Debye-Hockel)公式求得: 式中:Z1-电荷 -lgY,=0.512Z2 B-常数,25C时为0.00328 A-离子体积华数,三水化离子 半径,以pm(10-12)计,离子 的a值见P41附录表2-1 离子强度较小时,可不考虑水化离子大小 /仁溶液中离子强度 德拜-休克尔极限公式 'i-离子的活度集数,a、人 Zi记知时,ri值见P42附录表2 -lgY,=0.5Z√7 2 1= C:i离子浓度 Z:i离子电荷
+ − = B I I i Zi 1 å lg 0.512 2 活度系数 6 γ:对稀溶液 m<0.1mol/kg 或 c<0.10mol/L时 ,用德拜-休克尔(Debye-Hockel)公式求得: 式中:Zi-电荷 B-常数,25C时为0.00328 Å-离子体积系数,水化离子 半径,以pm(10-12)计,离子 的å值见P41附录表2-1 I-溶液中离子强度 ri-离子i的活度系数, å、 I、 Zi已知时, ri值见P42附录表2- 2 离子强度较小时,可不考虑水化离子大小, 德拜-休克尔极限公式: Z I i i 2 − lg = 0.5 = i i Zi I c 2 2 1 ci:i离子浓度 Zi:i离子电荷

例1计算0.10MOLL1HCL溶液中H+的活度。 解 OH+=YH+[H+]=YH+x0.1 mol/L 1=2∑c2=2Z+CZ) =x010 ml-.x+号x010mL× 2 =0.10mol.L a=0.83×0.10mol/L=0.083mol/L
例1 计算0.10 MOL·L -1 HCL溶液中H+的活度。 解 1 1 2 1 2 2 Cl 2 H 2 i i 0.10 mol L 0.10 mol L 1 2 1 0.10 mol L 1 2 1 ([H ] [Cl ] ) 2 1 2 1 − − − + − = = + I = c Z = Z + + Z − a = 0.83×0.10 mol/L = 0.083 mol/L αH+ =γH+[H+] =γH+ ×0.1 mol/L

例20.050mol/L的AICl3溶液中cc和aaI3+ 1=2∑e2=50050x32+3x0050x1)=030m01- 解 aa=300,aA=900,B=0.00328 -gy,=0.5122 1+Ba厅 -gyc=0.1882→yg-=0.66 -lgYA-=0.9644→Y4=0.11 高价离子影响大 .a=3×0.050×0.66=0.099molL a4=0.050×0.11=0.0055mol.L1
1 1 1 Cl A l 2 2 2 1 0.050 0.11 0.0055 3 0.050 0.66 0.099 lg 0.9644 0.11 lg 0.1882 0.66 lg 0.512 å 300 å 900 0.00328 (0.050 3 3 0.050 1 ) 0.30 2 1 2 1 3 3 3 - 3 − − + − = = = = − = = − = = − = = = = = = + = + − + + − − + a mol L a mol L Z B I c Z mol L A l Cl A l A l Cl Cl B a I I i i i i i , , 例2 0.050mol/L 的 AlCl3 溶液中 αCl- 和 αAl3+ 解 高价离子影响大
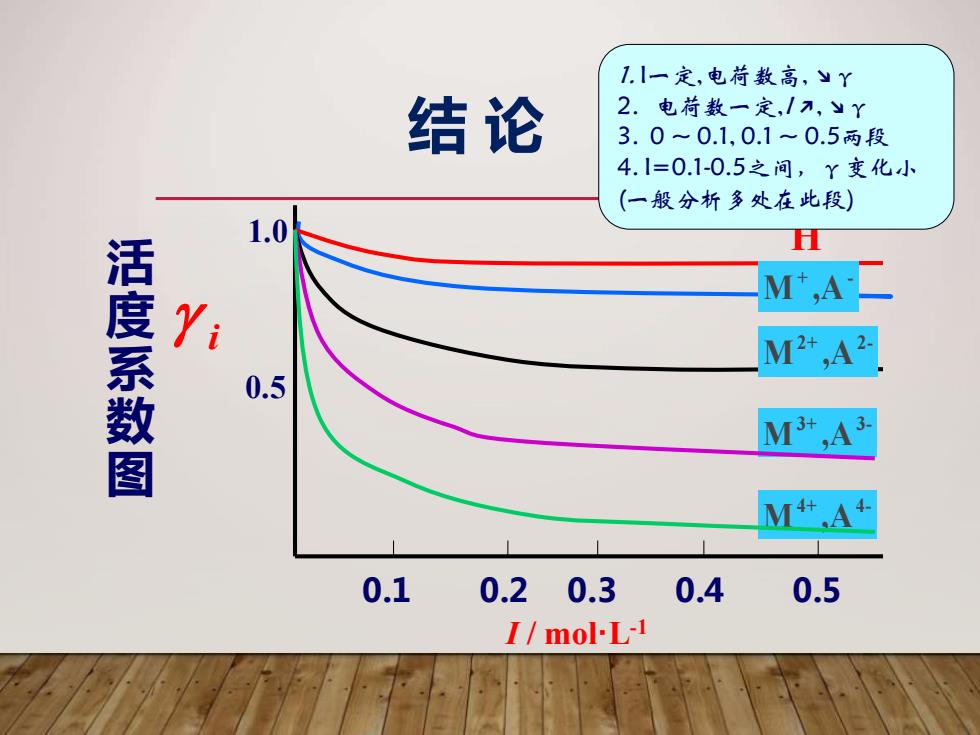
1.I一定,电荷数高,yY 结论 2.电荷数一定,/7,yY 3.0~0.1,0.1~0.5两段 4.1=0.1-0.5之问,Y变化小 (一般分析多处在此段) 1.0 H 活度系数图 M,A Yi M2+,A2 0.5 M3+,A3. M+ A+ 0.1 0.20.3 0.4 0.5 I/mol-L-1
活 度 系 数 图 0.1 0.2 0.3 0.4 0.5 1.0 0.5 i M ,A 3+ 3- M ,A 2+ 2- M ,A+ - + H M ,A 4+ 4- 1. I一定,电荷数高, ↘γ 2. 电荷数一定,I ↗, ↘γ 3. 0 ~ 0.1, 0.1 ~ 0.5两段 4. I=0.1-0.5之间,γ变化小 (一般分析多处在此段) I / mol·L-1 结 论

活度常数始、浓度常数及混合常数 1.活度常数K°: aA+bB cC+dD 形成常数 K 哈8 a 本章用K°处理平衡浓度之间的关系
活度常数Ka、浓度常数及混合常数 本章用K0 a处理平衡浓度之间的关系