
教 ©了解氧化还原滴定法的原理和特,点; ©掌握条件电位及其影响因素; 学 ©掌握条件平衡常数及其影响因素。 ©掌握影响氧化还原反应速度的因素
教 学 目 标 ☺ 了解氧化还原滴定法的原理和特点; ☺ 掌握条件电位及其影响因素; ☺ 掌握条件平衡常数及其影响因素。 ☺ 掌握影响氧化还原反应速度的因素

氧化还原滴定法概述 >定义:以氧化还原反应为基础的滴定分析方法。 >实质:电子的转移. >特点:1)机理复杂、多步反应 2)有的程度虽高但速度缓慢。 3)有的伴有副反应而无明确计量关系, >分类:碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法, 广泛,直接或间接测定无机物、有机物
氧化还原滴定法 概 述 ➢ 定 义:以氧化还原反应为基础的滴定分析方法。 ➢ 实 质:电子的转移. ➢ 特 点:1)机理复杂、多步反应. 2)有的程度虽高但速度缓慢. 3)有的伴有副反应而无明确计量关系. ➢ 分 类: 碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法. ➢ 应 用:广泛,直接或间接测定无机物、有机物
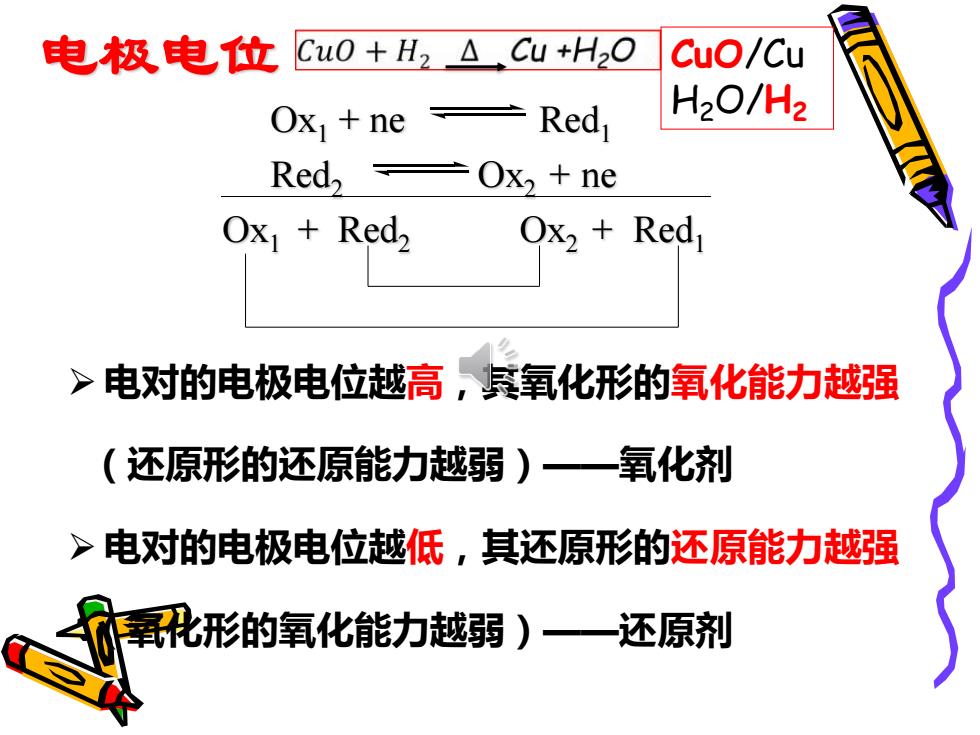
电极电位 Cu0+H2△Cu+H2O CuO/Cu Ox ne H2O/Hz Red,Ox2 ne Ox Red2 Ox2 Red >电对的电极电位越高氧化形的氧化能力越强 (还原形的还原能力越弱)—氧化剂 >电对的电极电位越低,其还原形的还原能力越强 氧化形的氧化能力越弱)—还原剂
电极电位 ➢ 电对的电极电位越高,其氧化形的氧化能力越强 (还原形的还原能力越弱)——氧化剂 ➢ 电对的电极电位越低,其还原形的还原能力越强 (氧化形的氧化能力越弱)——还原剂 Ox1 + ne Red1 Red2 Ox2 + ne Ox1 + Red2 Ox2 + Red1 CuO/Cu H2O/H2

>可逆电对:在反应的任一瞬间都能建立起平衡衡 合能斯特公式。Fe3+/Fe2+2/;Fe(CN63-/Fe(CN6 >不可逆电对:不能在反应的任一瞬间建立起平衡 实际电势与理论电势相较大。以能斯特公式计算 所得的结果,仅作参考。 Mn04-Mn2+,Cr2022-/Cr3+,S4062-/S2032
➢ 可逆电对:在反应的任一瞬间都能建立起平衡,符 合能斯特公式。Fe3+ /Fe2+ ; I2 /I- ; Fe(CN)6 3- /Fe(CN)6 4- ➢ 不可逆电对:不能在反应的任一瞬间建立起平衡, 实际电势与理论电势相差较大。以能斯特公式计算 所得的结果,仅作参考。 ➢ MnO4- /Mn2+ ,Cr2O7 2- /Cr3+ ,S4O6 2- /S2O3 2-

>对称电对:氧化态与还原态的系数相同。 如:Fe3++e=Fe2+; Mn04+8H++5e=Mn2++4H20 >不对称电对:氧化态与还原态系数不同。 如:2+2e=2; Cr2072-+14H++6e=2Cr3++7H20
➢ 对称电对:氧化态与还原态的系数相同。 如: Fe3+ + e = Fe2+; MnO4 - + 8H+ + 5e = Mn2+ + 4H2O ➢ 不对称电对:氧化态与还原态系数不同。 如: I2 + 2e = 2 I - ; Cr2O7 2- + 14H+ + 6e = 2Cr3+ + 7H2O