
复习回顾 0°=0°+0.059 lg YoraRed >条件电位及影响因素: 2 YRedaOx 电极电位越大,氧化性越强,还原性越弱;反之- 离子强度、生成沉淀、生成配合物、酸效应 >条件平衡常数计其影响因素 0.059 Ig K' △0≥0.35 nn, >反应速度及影响因素 应物浓度、温度、催化剂、诱导效应
复 习 回 顾 ➢条件电位及影响因素: 电极电位越大,氧化性越强,还原性越弱;反之- 离子强度、生成沉淀、生成配合物、酸效应 ➢条件平衡常数计其影响因素 ➢反应速度及影响因素 反应物浓度、温度、催化剂、诱导效应 d O x O x d n R e ' R e lg 0.059 = + lg 0.35 0.059 1 2 O' 2 O' 1 − = K n n

回 熟悉氧化还原滴定曲线及其相关计算, 款 熟练掌握化学计量点电位的计算及滴定 学 突越范围的计算(注意对称电位和不对 称电位的区别) © 熟悉氧化还原指示剂的分类及变色原理, 掌握常用的氧化还原滴定法的指示剂; 标
教 学 目 标 ☺ 熟悉氧化还原滴定曲线及其相关计算, 熟练掌握化学计量点电位的计算及滴定 突越范围的计算(注意对称电位和不对 称电位的区别); ☺ 熟悉氧化还原指示剂的分类及变色原理, 掌握常用的氧化还原滴定法的指示剂;

滴定曲线 n2Ox1+nRed2 nzRed1+njOx2 >随着滴定剂的加入,两个电对的电极电位不断发生变 化,并随时处于动态平衡中。可由任意一个电对计算出 溶液的电位值,对应加入的滴定剂体积绘制出滴定曲线 >滴定等当点前,常用被滴定物(量大)电对进行计算: >滴定等当点后,常用滴定剂(量大)电对进行计算;
滴定曲线 n2Ox1 + n1Red2 = n2Red1 + n1Ox2 ➢ 随着滴定剂的加入,两个电对的电极电位不断发生变 化,并随时处于动态平衡中。可由任意一个电对计算出 溶液的电位值,对应加入的滴定剂体积绘制出滴定曲线。 ➢ 滴定等当点前,常用被滴定物(量大)电对进行计算; ➢ 滴定等当点后,常用滴定剂(量大)电对进行计算;

0.1000mol·L1Ce(S0)2溶液滴定0.1000mol Fe2+的酸性溶液(1.0molL1硫酸) 滴定反应:Ce4++Fe2+=Ce3++Fe3+ 查表可知09ce+ce3+=1.44V;09Fe3*re2+=0.68V 1gK=144068=1296→该反应进行相当完全 0.059 反应为动态平衡,任何时刻两个电对的电极电位相等 g0e+00591ge-9+0059e Ce3+
0.1000 mol ·L-1 Ce(SO4 )2溶液滴定0.1000 mol ·L-1 Fe2+ 的酸性溶液(1.0 mol ·L-1硫酸) 滴定反应: Ce4+ + Fe2+ = Ce3+ + Fe3+ 查表可知' Ce4+/Ce3+= 1.44 V; ' Fe3+/Fe2+ = 0.68 V 反应为动态平衡,任何时刻两个电对的电极电位相等 + + + + + + + + + = + 3 o 4 4 3 2 o 3 3 2 C e ' C e C e /Ce F e ' F e F e /Fe 0.059lg 0.059lg c c c c = >> 该反应进行相当完全 − = 12.9 6 0.059 1.44 0.68 lg ' K
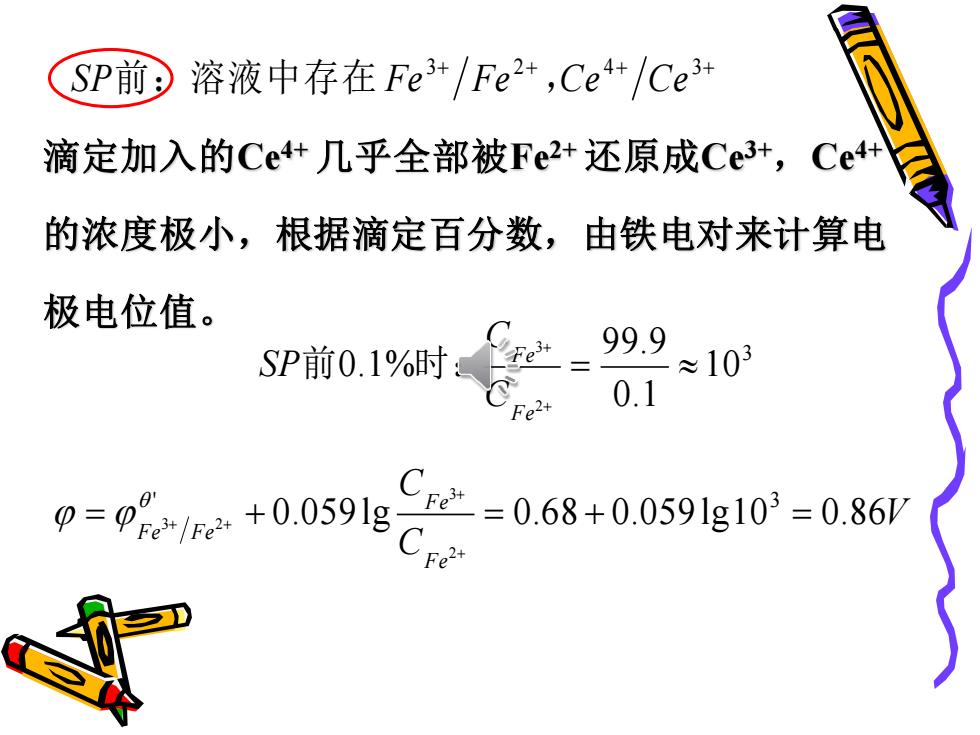
SP前 溶液中存在Fe3+/Fe2+,Ce4+/Ce3+ 滴定加入的Ce4+几乎全部被Fe2+还原成Ce3+,Ce4+ 的浓度极小,根据滴定百分数,由铁电对来计算电 极电位值。 99.9 SP前0.1%时: ≈103 0.1 00e*+0.0598C C2=0.68+0.059l1g103=0.86
3+ 2+ 4+ 3+ S P前:溶液中存在 F e F e ,C e C e 3 10 0.1 99.9 0.1% 2 3 = + + F e F e C C SP前 时: V C C F e F e F e F e 0.059 lg 0.6 8 0.059 lg1 0 0.8 6 ' 3 2 3 = 3 2 + = + = + + + + 滴定加入的Ce4+ 几乎全部被Fe2+ 还原成Ce3+ ,Ce4+ 的浓度极小,根据滴定百分数,由铁电对来计算电 极电位值