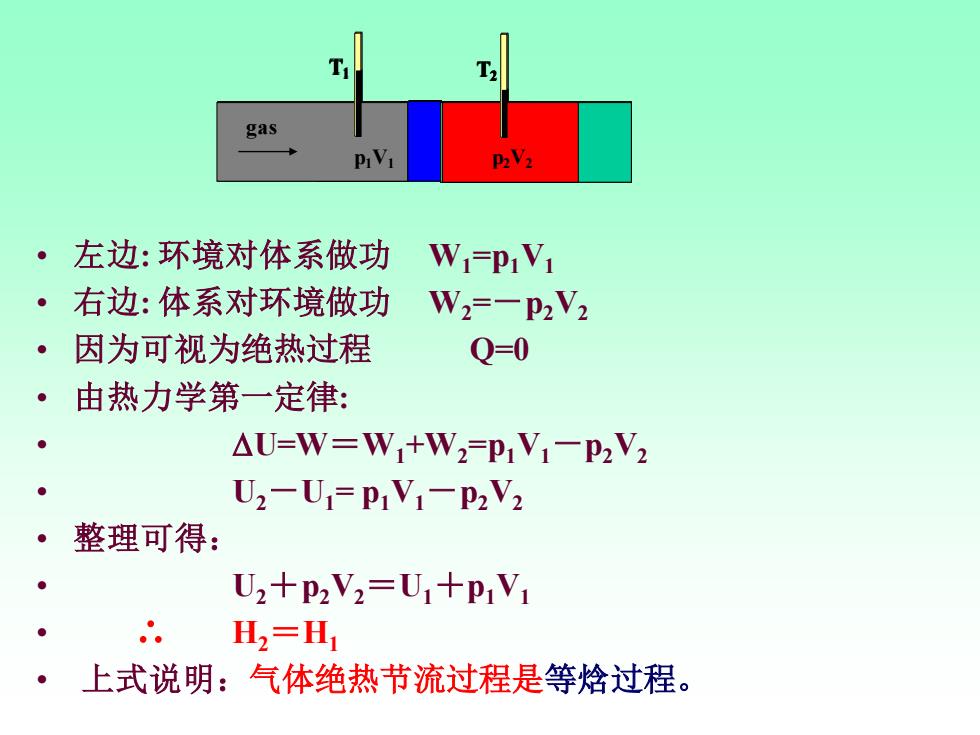
gas 。左边:环境对体系做功 W-P1V1 ·右边:体系对环境做功 W2=-P2V2 ·因为可视为绝热过程 Q=0 ·由热力学第一定律: △U=W=W+W2-pV1-P2V2 U2-U=PiV1-P2V2 整理可得: ● U2+P2V2=U1+p1V1 H,=H 上式说明:气体绝热节流过程是等焓过程
• 左边: 环境对体系做功 W1=p1V1 • 右边: 体系对环境做功 W2=-p2V2 • 因为可视为绝热过程 Q=0 • 由热力学第一定律: • U=W=W1+W2=p1V1-p2V2 • U2-U1= p1V1-p2V2 • 整理可得: • U2+p2V2=U1+p1V1 • ∴ H2=H1 • 上式说明:气体绝热节流过程是等焓过程。 gas p1V1 T1 T2 gas p1V1 T1 T2 p2V2 gas p1V1 T1 T2 p2V2 gas p1V1 T1 T2 p2V2

·气体经J一T等焓节流后,温度会发生变化: 令: -(T/op)H ·:J-T系数 4≤0 dp<0 dT>0 气体节流后温度升高; ● >0 dp<0 dT<0 气体节流后温度降低; ● 4=0 气体节流后温度不变 ·大多数气体的u在常温下大于零,故节流后温度 降低
• 气体经J-T等焓节流后,温度会发生变化: • 令: =(T/p)H • : J-T系数 • <0 dp<0 dT>0 气体节流后温度升高; • >0 dp<0 dT<0 气体节流后温度降低; • =0 气体节流后温度不变. • 大多数气体的在常温下大于零, 故节流后温度 降低

。利用J-T效应,可以使液化. ·氢气曾被认为是不可液化的气体,因为在常温下,氢 气经节流膨胀后,温度不但不降低,反而升高.这是因 为氢气的J-T系数在常温下小于零的缘故.当将氢气温 度降至195K以下时,氢气的u才变为正值,在此温度之 下,对氢气进行节流膨胀,氢气才会液化. ·气体的J-T系数是温度的函数.在某一特定温度值下, 气体的J-T系数等于零:μ=0,此时所对应的温度称为: 转化温度(inversion temperature) ·气体在转化温度下进行节流膨胀,气温不会发生变化
• 利用J-T效应, 可以使液化. • 氢气曾被认为是不可液化的气体, 因为在常温下, 氢 气经节流膨胀后, 温度不但不降低, 反而升高. 这是因 为氢气的J-T系数在常温下小于零的缘故.当将氢气温 度降至195K以下时, 氢气的才变为正值, 在此温度之 下,对氢气进行节流膨胀, 氢气才会液化. • 气体的J-T系数是温度的函数. 在某一特定温度值下, 气体的J-T系数等于零: =0,此时所对应的温度称为: • 转化温度(inversion temperature) • 气体在转化温度下进行节流膨胀, 气温不会发生变化