
反应情况等。如果存在临床使用中断情况,应当说明其原因。 (四)临床实践数据 临床实践的原始数据主要来源于医院信息系统及病案 库等原始记录数据,包括结构化和非结构化数据,数字化或 非数字化的病历记录。临床实践的数据还可以来源于既往开 展的临床研究。 1.病历记录数据 病历记录数据是最主要的临床实践数据来源。目前的病 历记录绝大多数使用的是电子病历,但也有可能是纸质病历 记录形式。无论何种形式,都需要经过数据治理才能达到后 续分析的要求,并符合注册申报的递交标准。 一般而言,门诊和急诊病历记录的信息量较少,院外数 据缺失较多,特别是临床结局变量,直接影响到个体病例纵 向数据的完整性,此类数据用于临床研究应当非常慎重。因 此,应当通过信息化手段加强门诊和急诊病历记录的完整性, 提升数据质量,从而支持中药的临床研发。 2.临床研究数据 对于既往针对中药复方制剂开展的临床研究,无论是前 瞻性或回顾性观察性研究,还是随机对照临床试验,其数据 质量通常优于医疗实践中的病历记录。针对同一中药复方制 剂开展的临床研究可能有多项,而且研究类型也可能有多种
5 反应情况等。如果存在临床使用中断情况,应当说明其原因。 (四)临床实践数据 临床实践的原始数据主要来源于医院信息系统及病案 库等原始记录数据,包括结构化和非结构化数据,数字化或 非数字化的病历记录。临床实践的数据还可以来源于既往开 展的临床研究。 1.病历记录数据 病历记录数据是最主要的临床实践数据来源。目前的病 历记录绝大多数使用的是电子病历,但也有可能是纸质病历 记录形式。无论何种形式,都需要经过数据治理才能达到后 续分析的要求,并符合注册申报的递交标准。 一般而言,门诊和急诊病历记录的信息量较少,院外数 据缺失较多,特别是临床结局变量,直接影响到个体病例纵 向数据的完整性,此类数据用于临床研究应当非常慎重。因 此,应当通过信息化手段加强门诊和急诊病历记录的完整性, 提升数据质量,从而支持中药的临床研发。 2.临床研究数据 对于既往针对中药复方制剂开展的临床研究,无论是前 瞻性或回顾性观察性研究,还是随机对照临床试验,其数据 质量通常优于医疗实践中的病历记录。针对同一中药复方制 剂开展的临床研究可能有多项,而且研究类型也可能有多种

例如有回顾性研究也有前瞻性研究,有观察性研究也有干预 性研究等。如果这些研究没有执行统一的数据标准,或所采 用的标准不符合注册研究的要求,需要先对来源于这些研究 的数据进行统一和规范的治理,才可能适用于后续的以注册 上市为目的的数据分析。此外,这些研究数据应当可溯源到 原始的病历记录,或可溯源到所开展项目独立收集并录入的 源数据库。 对来源于同一固定的中药处方或中药复方制剂开展的 多项临床研究的数据,如需合并分析(如meta分析),鼓励 该分析基于各项临床研究的个体层面数据,而非从研究报告 摘录的汇总统计量。 五、基于人用经验的中药复方制剂新药临床研发策略 遵循“三结合”审评证据体系,在有充分的中医药理论 的前提下,人用经验可用于支持中药复方制剂新药的研发决 策或注册申请。基于人用经验的临床研发策略如图1所示。 6
6 例如有回顾性研究也有前瞻性研究,有观察性研究也有干预 性研究等。如果这些研究没有执行统一的数据标准,或所采 用的标准不符合注册研究的要求,需要先对来源于这些研究 的数据进行统一和规范的治理,才可能适用于后续的以注册 上市为目的的数据分析。此外,这些研究数据应当可溯源到 原始的病历记录,或可溯源到所开展项目独立收集并录入的 源数据库。 对来源于同一固定的中药处方或中药复方制剂开展的 多项临床研究的数据,如需合并分析(如 meta 分析),鼓励 该分析基于各项临床研究的个体层面数据,而非从研究报告 摘录的汇总统计量。 五、基于人用经验的中药复方制剂新药临床研发策略 遵循“三结合”审评证据体系,在有充分的中医药理论 的前提下,人用经验可用于支持中药复方制剂新药的研发决 策或注册申请。基于人用经验的临床研发策略如图 1 所示
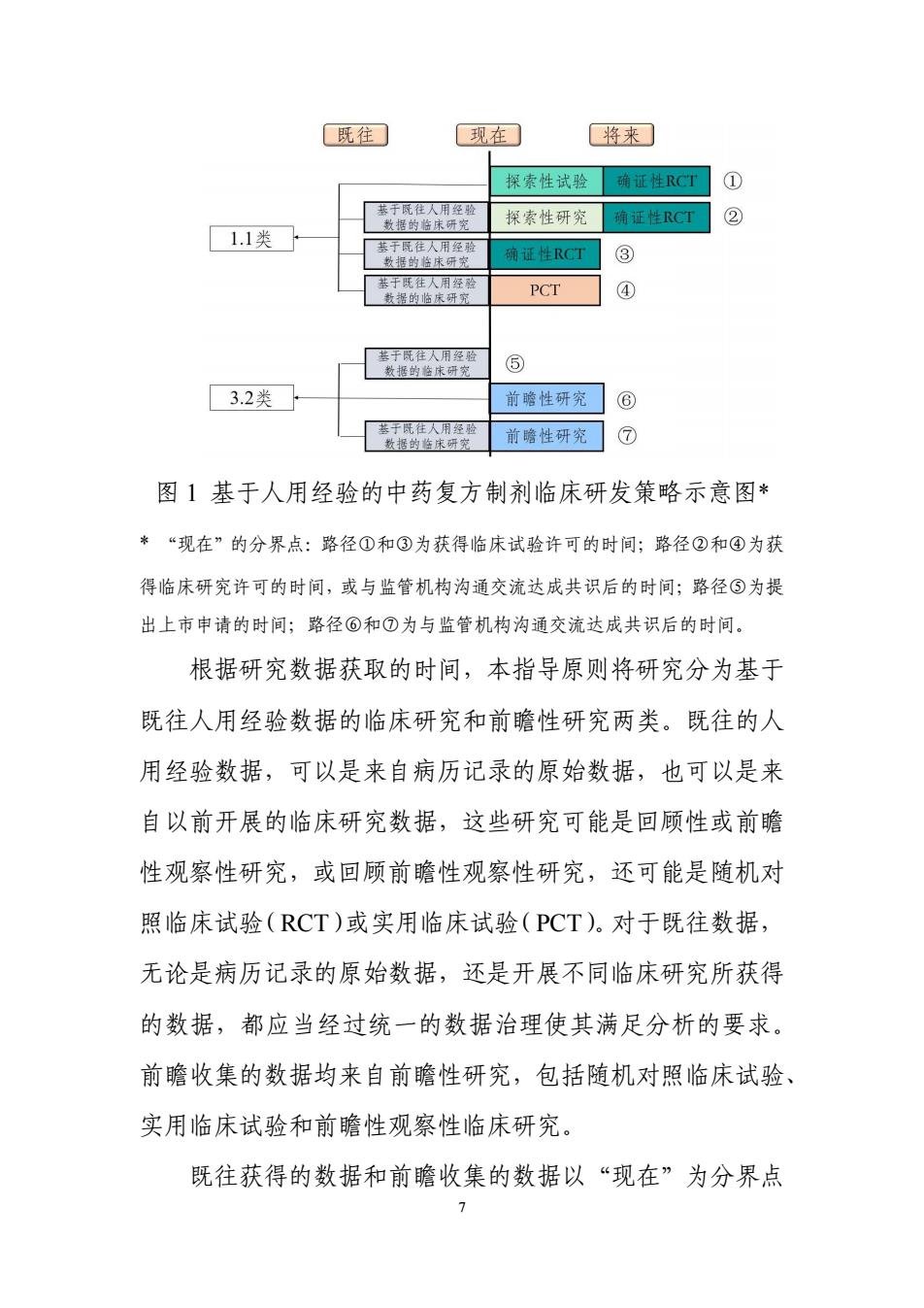
既往 现在 将来 探索性试验 确证性RCT ① 基于既往人用经验 数据的临床研究 探索性研究 确证性RCT ② 11类 基于既往人用经验 数据的检床研究 确证性RCT ③ 基于既往人用经验 数据的临床研究 PCT ④ 基于既往人用经验 数据的在床研究 ⑤ 3.2类 前瞻性研究 ⑥ 基于既往人用经验 数据的临床研究 前瞻性研究 ⑦ 图1基于人用经验的中药复方制剂临床研发策略示意图* *“现在”的分界点:路径①和③为获得临床试验许可的时间;路径②和④为获 得临床研究许可的时间,或与监管机构沟通交流达成共识后的时间;路径⑤为提 出上市申请的时间;路径⑥和⑦为与监管机构沟通交流达成共识后的时间。 根据研究数据获取的时间,本指导原则将研究分为基于 既往人用经验数据的临床研究和前瞻性研究两类。既往的人 用经验数据,可以是来自病历记录的原始数据,也可以是来 自以前开展的临床研究数据,这些研究可能是回顾性或前瞻 性观察性研究,或回顾前瞻性观察性研究,还可能是随机对 照临床试验(RCT)或实用临床试验(PCT)。对于既往数据, 无论是病历记录的原始数据,还是开展不同临床研究所获得 的数据,都应当经过统一的数据治理使其满足分析的要求。 前瞻收集的数据均来自前瞻性研究,包括随机对照临床试验、 实用临床试验和前瞻性观察性临床研究。 既往获得的数据和前瞻收集的数据以“现在”为分界点 7
7 图 1 基于人用经验的中药复方制剂临床研发策略示意图* * “现在”的分界点:路径①和③为获得临床试验许可的时间;路径②和④为获 得临床研究许可的时间,或与监管机构沟通交流达成共识后的时间;路径⑤为提 出上市申请的时间;路径⑥和⑦为与监管机构沟通交流达成共识后的时间。 根据研究数据获取的时间,本指导原则将研究分为基于 既往人用经验数据的临床研究和前瞻性研究两类。既往的人 用经验数据,可以是来自病历记录的原始数据,也可以是来 自以前开展的临床研究数据,这些研究可能是回顾性或前瞻 性观察性研究,或回顾前瞻性观察性研究,还可能是随机对 照临床试验(RCT)或实用临床试验(PCT)。对于既往数据, 无论是病历记录的原始数据,还是开展不同临床研究所获得 的数据,都应当经过统一的数据治理使其满足分析的要求。 前瞻收集的数据均来自前瞻性研究,包括随机对照临床试验、 实用临床试验和前瞻性观察性临床研究。 既往获得的数据和前瞻收集的数据以“现在”为分界点