
3.3.5嫡增加原理the principle of the increase entropy 对于绝热系统,δQ=0,所以Clausius不等式为 dS≥0 等号表示绝热可逆过程,不等号表示绝热不 可逆过程。熵增加原理可表述为:在绝热条件 下,趋向于平衡衡的过程使系统的熵增加。或者说 在绝热条件下,不可能发生熵减少的过程。 如果是一个隔离系统,环境与体系间既无热 的交换,又无功的交换,则熵增加原理可表述 为:一个孤立体系的熵永不减少
3.3.5 熵增加原理the principle of the increase entropy 对于绝热系统, δQ = 0 ,所以Clausius 不等式为 d 0 S ≥ 等号表示绝热可逆过程,不等号表示绝热不 可逆过程。熵增加原理可表述为:在绝热条件 下,趋向于平衡的过程使系统的熵增加。或者说 在绝热条件下,不可能发生熵减少的过程。 如果是一个隔离系统,环境与体系间既无热 的交换,又无功的交换,则熵增加原理可表述 为:一个孤立体系的熵永不减少

用△S来判断过程的自发性时,必须把与 系统密切相关的环境也包括在一起,即: △S(隔离)=△S(系统)十△S(环境)≥0 △Sso=△Ss+△Samb≥0 >”号为自发过程 =”号为可逆过程
用△S来判断过程的自发性时,必须把与 系统密切相关的环境也包括在一起,即: △S(隔离)=△S(系统)+△S(环境) ≥ 0 △Siso=△Ssys+△Samb ≥ 0 “>” 号为自发过程 “=” 号为可逆过程

3.3.6平衡的熵判据 (entropy criterion of equilibrium) △Siso=△Ss+△Samb≥0 dSs=dSys十d.Samb≥0 隔离系统中各物质的熵S的总和永不减少
3.3.6 平衡的熵判据 (entropy criterion of equilibrium) △Siso=△Ssys+△Samb≥0 dSiso=dSsys+dSamb≥0 隔离系统中各物质的熵S的总和永不减少
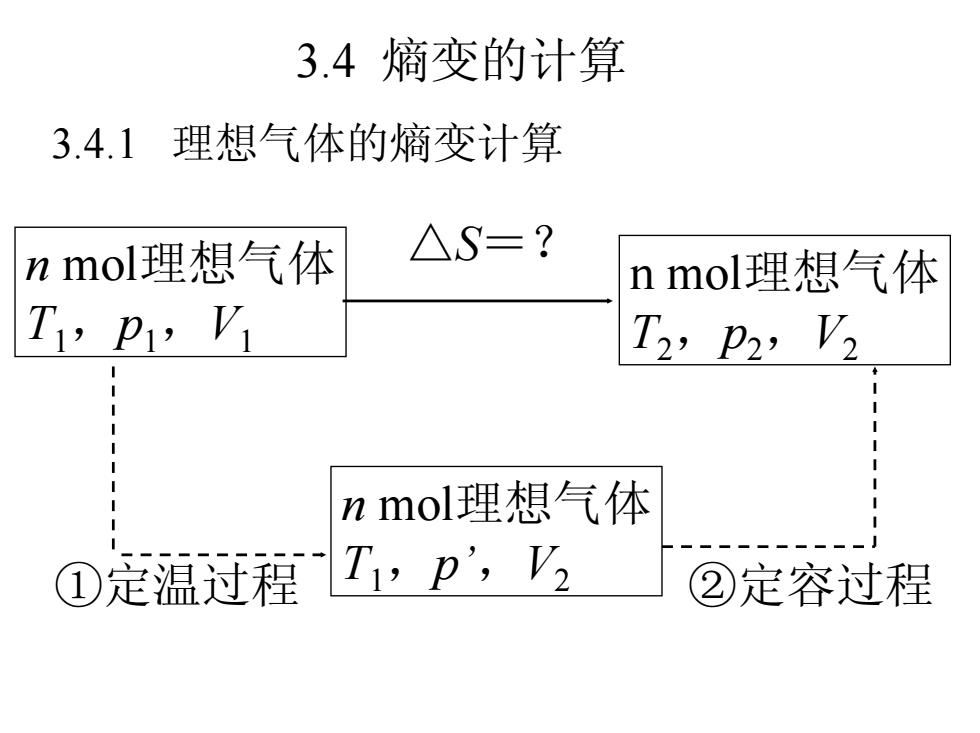
3.4熵变的计算 3.4.1理想气体的熵变计算 nmol理想气体 △S=? nmol理想气体 T,p,V T2,p2,V2 nmol理想气体 ①定温迂灌I,p,V, ②定容过程
3.4 熵变的计算 3.4.1 理想气体的熵变计算 n mol理想气体 ①定温过程 T1,p’,V2 ②定容过程 n mol理想气体 T1,p1,V1 n mol理想气体 T2,p2,V2 △S=?

对于过程1:△U1=0,Q,1=-W,1 3-坠0.=打s,nr==Rn号 , 对于过程2:W,2=0,2,2=△U2 =g-j%∫7cnn a5 n,号
对于过程1:△U1=0,Qr,1=-Wr,1 1 2 V V r,1 r,1 r,1 1 ln 1 1 1 2 1 V V nR V dV pdV nR T W T Q T T Q S = δ = − δ = = = δ ∆ = ∫ ∫ ∫ ∫ ∫ 对于过程2: Wr,2 =0,Qr,2= △U2 1 2 V,m r,2 2 V,m 2 ln TT nC T nC dT TdU TQ S = = = δ ∆ = ∫ ∫ ∫ 1 2 V,m 1 2 ln ln T T nC V V ∆S = nR +