
教案 姓名孙红2010~2011学年第一学期时间2010.10.8节次1-3
12 教 案 姓名_孙红_ 2010 ~ 2011 学年第 一 学期 时间_2010.10.8 节次_1-3_
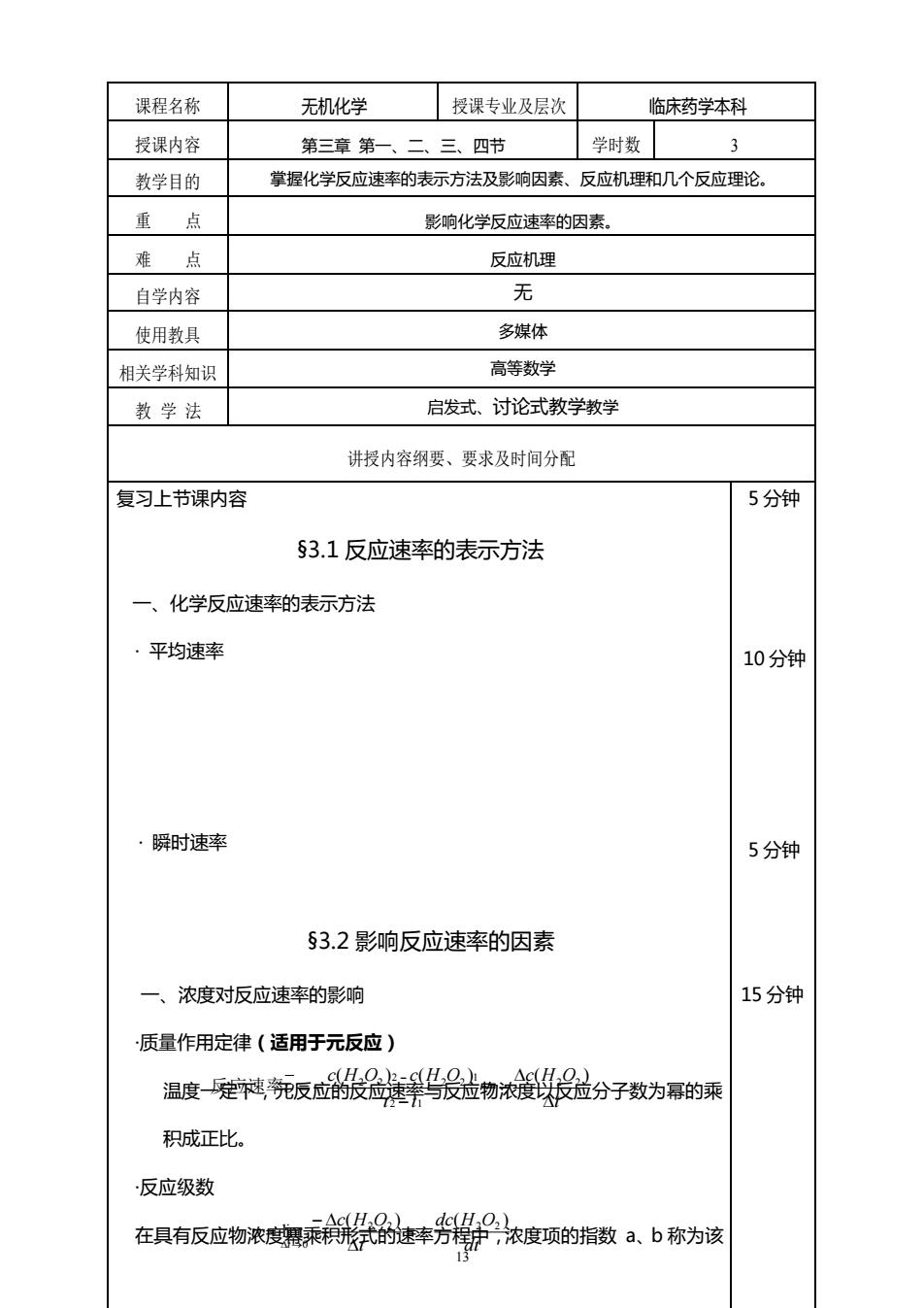
课程名称 无机化学 授课专业及层次 临床药学本科 授课内容 第三章第一、二、三、四节 学时数 3 教学目的 掌握化学反应速率的表示方法及影响因素、反应机理和几个反应理论。 重点 影响化学反应速率的因素。 难点 反应机理 自学内容 无 使用教具 多媒体 相关学科知识 高等数学 教学法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 5分钟 §3.1反应速率的表示方法 一、化学反应速率的表示方法 平均速率 10分钟 瞬时速率 5分钟 §3.2影响反应速率的因素 一、浓度对反应速率的影响 15分钟 质量作用定律(适用于元反应) 温度建菜统反应品号最益物浓證发益分子数为幂的乘 积成正比。 反应级数 在具有反应物浓速车芳浓度项的指数从.b称为该 护
13 课程名称 无机化学 授课专业及层次 临床药学本科 授课内容 第三章 第一、二、三、四节 学时数 3 教学目的 掌握化学反应速率的表示方法及影响因素、反应机理和几个反应理论。 重 点 影响化学反应速率的因素。 难 点 反应机理 自学内容 无 使用教具 多媒体 相关学科知识 高等数学 教 学 法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 §3.1 反应速率的表示方法 一、化学反应速率的表示方法 · 平均速率 · 瞬时速率 §3.2 影响反应速率的因素 一、浓度对反应速率的影响 ·质量作用定律(适用于元反应) 温度一定下,元反应的反应速率与反应物浓度以反应分子数为幂的乘 积成正比。 ·反应级数 在具有反应物浓度幂乘积形式的速率方程中,浓度项的指数 a、b 称为该 5 分钟 10 分钟 5 分钟 15 分钟 t c H O t t c H O c H O − − = − ( ) − ( ) ( ) 2 2 2 1 1 2 2 2 反应速率 2 2 = dt dc H O t c H O t ( ) ( ) lim 2 2 2 2 0 = − − = →

讲授内容纲要、要求及时间分配(附页) 反应物的级数;所有反应物的级数之和a+b=n称为该反应的总级数 简称反应级数 10分钟 对于可逆反应,因吸热反应的活化能大于放热反应的活化能,温度升高时 15分钟 吸热的反应速率增大较多,所以温度升高平衡向吸热方向移动。 示例:3-4 二、温度对化学反应速率的影响 20分钟 ,Arrhenius方程式(强调其应用) 温度对化学反应速率影响的原因 53.3反应机理 一、反应机理概念 10分钟 基元反应和非基元反应 由反应物一步就直接转变为生成物的反应称为基元反应,又称元反应。 由两个或两个以上的基元反应组成的化学反应称为非基元反应,也叫总反 应 20分钟 反应分子数 在基元反应中反应物微粒数之和称为反应分子数,不是反应方程式中反应 物的计量系数之和,它是需要同时碰撞才能发生化学反应的微粒, 二、限速步骤(举例) §3.4反应速率理论简介 一、碰撞理论(针对汉分子气体反应)
14 讲授内容纲要、要求及时间分配(附页) 反应物的级数;所有反应物的级数之和 a + b = n 称为该反应的总级数, 简称反应级数。 对于可逆反应,因吸热反应的活化能大于放热反应的活化能,温度升高时, 吸热的反应速率增大较多,所以温度升高平衡向吸热方向移动。 示例:3-4 二、温度对化学反应速率的影响 ·Arrhenius 方程式(强调其应用) ·温度对化学反应速率影响的原因 §3.3 反应机理 一、反应机理概念 · 基元反应和非基元反应 由反应物一步就直接转变为生成物的反应称为基元反应,又称元反应。 由两个或两个以上的基元反应组成的化学反应称为非基元反应,也叫总反 应。 · 反应分子数 在基元反应中反应物微粒数之和称为反应分子数,不是反应方程式中反应 物的计量系数之和,它是需要同时碰撞才能发生化学反应的微粒。 二、限速步骤(举例) §3.4 反应速率理论简介 一、碰撞理论(针对双分子气体反应) 10 分钟 15 分钟 20 分钟 10 分钟 20 分钟

,有效碰撞与弹性碰撞 能发生反应的碰撞,叫做有效碰撞 不发生反应的碰撞,叫做弹性碰撞 二、过渡态理论简介 20分钟 化学反应不只是通过反应物分子间的简单碰撞就生成产物,而是要经过 个中间的过渡状态。 ,活化络合物(旧键与新键同时存在的状态) 活化能与反应热 活化分子具有的最低能量与反应物分子的平均能量之差,称为活化能,用 符号Ea表示,单位为kJ/mol。 △rH=Ea-E 6>E·△rH>0,正反应吸热 6<6'△rH<0,正反应放热 活化分子与活化能 三、催化剂和酶 20分钟 1、催化剂及催化作用 催化剂 催化剂的特点(改变反应速率但不改变平衡;有选择性) 2、催化作用理论 均相催化理论一中间产物学说 ·多相催化理论一活化中心学说 3、生物催化剂一酶(自学)高活性、高选择性、适宜温度低等特点 课后习题:P52第1、3、4、5、9、14题
15 ·有效碰撞与弹性碰撞 能发生反应的碰撞,叫做有效碰撞 不发生反应的碰撞,叫做弹性碰撞 二、过渡态理论简介 化学反应不只是通过反应物分子间的简单碰撞就生成产物,而是要经过一 个中间的过渡状态。 ·活化络合物 (旧键与新键同时存在的状态) 活化能与反应热 活化分子具有的最低能量与反应物分子的平均能量之差,称为活化能,用 符号“Ea”表示,单位为 kJ/mol。 ΔrH = Ea - Ea Ea >Ea‘ ΔrH >0,正反应吸热 Ea <Ea‘ ΔrH < 0,正反应放热 ·活化分子与活化能 三、催化剂和酶 1、催化剂及催化作用 ·催化剂 ·催化剂的特点(改变反应速率但不改变平衡;有选择性) 2、 催化作用理论 ·均相催化理论—中间产物学说 ·多相催化理论—活化中心学说 3、生物催化剂—酶(自学)高活性、高选择性、适宜温度低等特点 课后习题:P52 第 1、3、4、5、9、14 题。 20 分钟 20 分钟
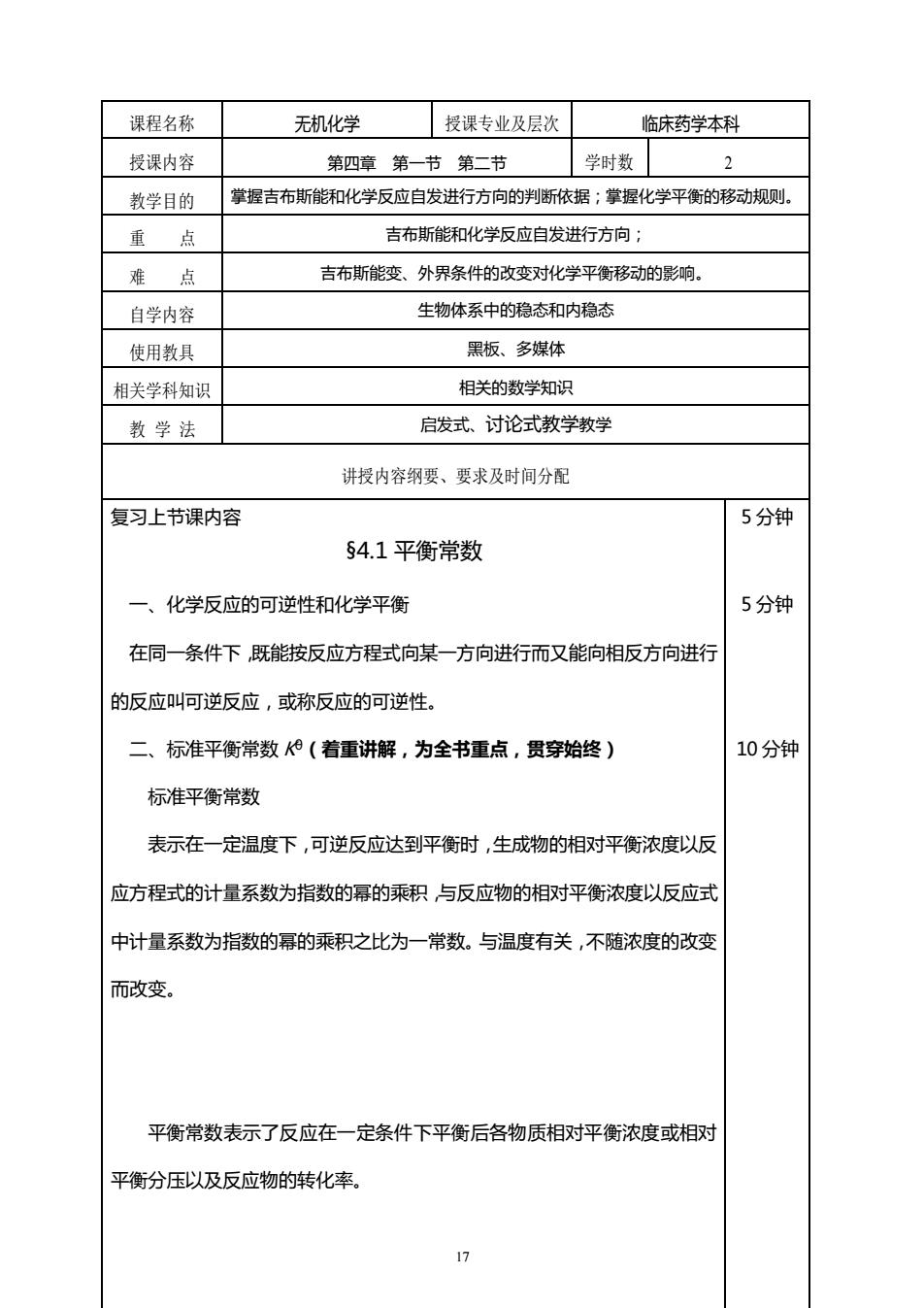
课程名称 无机化学授课专业及层次 临床药学本科 授课内容 第四章第一节第二节 学时数 2 教学目的 掌握吉布斯能和化学反应自发进行方向的判断依据;掌握化学平衡的移动规则。 重点 吉布斯能和化学反应自发进行方向; 难点 吉布斯能变、外界条件的改变对化学平衡移动的影响。 自学内容 生物体系中的稳态和内稳态 使用教具 黑板、多媒体 相关学科知识 相关的数学知识 教学法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 5分钟 54.1平衡常数 一、化学反应的可逆性和化学平衡 5分钟 在同一条件下既能按反应方程式向某一方向进行而又能向相反方向进行 的反应叫可逆反应,或称反应的可逆性。 二、标准平衡常数(着重讲解,为全书重点,贯穿始终) 10分钟 标准平衡常数 表示在一定温度下,可逆反应达到平衡时,生成物的相对平衡浓度以反 应方程式的计量系数为指数的幂的乘积与反应物的相对平衡浓度以反应式 中计量系数为指数的幂的乘积之比为一常数。与温度有关,不随浓度的改变 而改变。 平衡常数表示了反应在一定条件下平衡后各物质相对平衡浓度或相对 平衡分压以及反应物的转化率
17 课程名称 无机化学 授课专业及层次 临床药学本科 授课内容 第四章 第一节 第二节 学时数 2 教学目的 掌握吉布斯能和化学反应自发进行方向的判断依据;掌握化学平衡的移动规则。 重 点 吉布斯能和化学反应自发进行方向; 难 点 吉布斯能变、外界条件的改变对化学平衡移动的影响。 自学内容 生物体系中的稳态和内稳态 使用教具 黑板、多媒体 相关学科知识 相关的数学知识 教 学 法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 §4.1 平衡常数 一、化学反应的可逆性和化学平衡 在同一条件下,既能按反应方程式向某一方向进行而又能向相反方向进行 的反应叫可逆反应,或称反应的可逆性。 二、标准平衡常数 Kθ(着重讲解,为全书重点,贯穿始终) 标准平衡常数 表示在一定温度下,可逆反应达到平衡时,生成物的相对平衡浓度以反 应方程式的计量系数为指数的幂的乘积,与反应物的相对平衡浓度以反应式 中计量系数为指数的幂的乘积之比为一常数。与温度有关,不随浓度的改变 而改变。 平衡常数表示了反应在一定条件下平衡后各物质相对平衡浓度或相对 平衡分压以及反应物的转化率。 5 分钟 5 分钟 10 分钟