
讲授内容纲要、要求及时间分配(附页) 离子强度【反映了溶液中存在的离子所产生电场强度的强弱,仅与溶液中 各离子的浓度和电荷数有关,而与离子的本性无关。离子浓度愈大,价 数愈高,则溶液的离子强度愈大,离子间的牵制作用愈强,活度系数愈小 例(1-6)(1-7) 15分钟 第二章化学反应的方向 S2.1热力学第一定律 一、基本概念(举例说明,学生更易接受) 15分钟 体系和环境 体系:热力学中被研究的对像。 体系以外并且与体系密切相关的部分称为环境。 体系的分类:开放系统封闭系统,隔离系统 状态和状态函数 状态:由一系列表征体系性质的物理量所确定下来的体系的一种存在形 式,称为体系的状态。 状态函数:确定体系状态的物理量,称为状态函数。P、V、T、n等。 可分为广度性质的状态函数和强度性质的状态函数。 过程和途径等温过程、等压过程、等容过程 二、热力学第一定律 10分钟 (一)热和功: ().定义:由于温度不同在环境和体系间交换或传递的能量为热。 除热外其它形式被传递的能量为功。 (2正负号的规定:吸热为正,放热为负。环境对体系做功为正,体
7 讲授内容纲要、要求及时间分配(附页) 离子强度 I 反映了溶液中存在的离子所产生电场强度的强弱。仅与溶液中 各离子的浓度和电荷数有关,而与离子的本性无关。离子浓度愈大,价 数愈高,则溶液的离子强度愈大,离子间的牵制作用愈强,活度系数愈小。 例(1-6)(1-7) 第二章 化学反应的方向 §2.1 热力学第一定律 一、基本概念(举例说明,学生更易接受) ·体系和环境 体系:热力学中被研究的对象。 体系以外并且与体系密切相关的部分称为环境。 体系的分类:开放系统 ,封闭系统 ,隔离系统 ·状态和状态函数 状态:由一系列表征体系性质的物理量所确定下来的体系的一种存在形 式,称为体系的状态。 状态函数: 确定体系状态的物理量,称为状态函数。P、V、T、n 等。 可分为广度性质的状态函数和强度性质的状态函数。 ·过程和途径 等温过程、等压过程、等容过程 二、热力学第一定律 (一)热和功: (1).定义:由于温度不同在环境和体系间交换或传递的能量为热。 除热外其它形式被传递的能量为功。 (2).正负号的规定 :吸热为正,放热为负。环境对体系做功为正,体 15 分钟 15 分钟 10 分钟

系对环境做功为负。 (3)特点:热和功不是状态函数,热和功的变化数值与系统的变化途径 密切相关。 (4).分类:体积功和非体积功 (二)内能 10分钟 (1).内能的定义:内能是系统内部一切能量形式的总和,常用符号"U“ 表示。 (2)特点:内能是状态函数,它的变化值只取决于体系的始态和终态 与变化的途径无关。 (三)热力学第一定律 10分钟 能量转化和守恒定律 AU=Q+W 示例: §2.2化学反应的热效应 封闭系统而且非体积功为零的条件下,当生成物和反应物的温度相同时 化学反应过程中吸收或放出的热量,简称反应热,亦称热效应。 一、等容反应热和等压反应热 Qv=AU 10分钟 Qp =AU +PAV H=U+PV Qp=h-Hh=△H U、P、V都是状态函数,其组合(U+PV)也是状态函数热力学中将这 状态函数称为焓(enthalpy),用符号H表示,具有广度性质
8 系对环境做功为负。 (3)特点:热和功不是状态函数,热和功的变化数值与系统的变化途径 密切相关。 (4).分类:体积功和非体积功 (二)内能 (1).内能的定义:内能是系统内部一切能量形式的总和,常用符号“U” 表示。 (2).特点:内能是状态函数,它的变化值只取决于体系的始态和终态, 与变化的途径无关。 (三)热力学第一定律 能量转化和守恒定律 ΔU=Q+W 示例: §2.2 化学反应的热效应 封闭系统而且非体积功为零的条件下,当生成物和反应物的温度相同时, 化学反应过程中吸收或放出的热量,简称反应热,亦称热效应。 一、等容反应热和等压反应热 Qv = ΔU Qp =ΔU +PΔV H=U+PV Qp = H2 – H1 =ΔH U、P、V 都是状态函数,其组合(U+ PV)也是状态函数热力学中将这一 状态函数称为焓(enthalpy),用符号“H”表示,具有广度性质。 10 分钟 10 分钟 10 分钟

二、反应进度 反应进度表示反应进行的程度,常用的号,(希腊字母读作ks)表示 10分钟 = 三、热化学方程式 化学反应的热效应是当生成物与反应物的温度相同时,化学反应中吸收 15分钟 或放出的热量。 表示化学反应与热效应关系的方程式,称为热化学方程式 课后习题都做 案
9 二、反应进度 反应进度表示反应进行的程度,常用符号“ξ ”(希腊字母读作“ksi”)表示。 三、热化学方程式 化学反应的热效应是当生成物与反应物的温度相同时,化学反应中吸收 或放出的热量。 表示化学反应与热效应关系的方程式,称为热化学方程式 课后习题都做 10 分钟 15 分钟 教 案 B nB nB ( )− (0) =
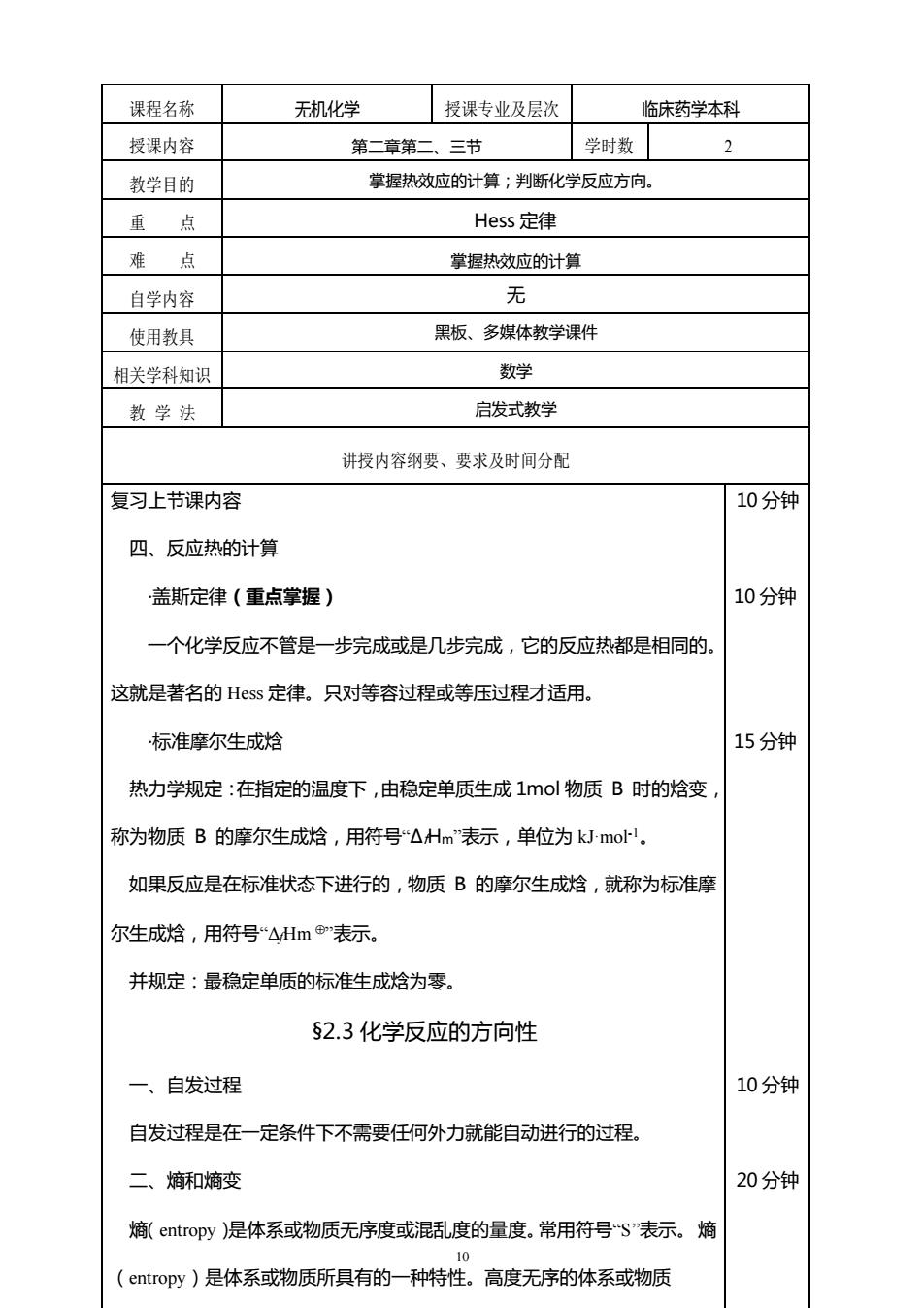
课程名称 无机化学 授课专业及层次 临床药学本科 授课内容 第二章第二、三节 学时数 2 教学目的 掌据热效应的计算;判断化学反应方向。 重点 Hess定律 难点 掌握热效应的计算 自学内容 无 使用教具 黑板、多媒体教学课件 相关学科知识 数学 教学法 启发式教学 讲授内容纲要、要求及时间分配 复习上节课内容 10分钟 四、反应热的计算 盖斯定律(重点掌握) 10分钟 一个化学反应不管是一步完成或是几步完成,它的反应热都是相同的. 这就是著名的Hs定律。只对等容过程或等压过程才适用。 标准摩尔生成焓 15分钟 热力学规定:在指定的温度下,由稳定单质生成1mol物质B时的焓变 称为物质B的摩尔生成焓,用符号△Hm表示,单位为kJ-moF1, 如果反应是在标准状态下进行的,物质B的摩尔生成焓,就称为标准摩 尔生成焓,用符号“4Hm表示。 并规定:最稳定单质的标准生成焓为零 §2.3化学反应的方向性 一、自发过程 10分钟 自发过程是在一定条件下不需要任何外力就能自动进行的过程。 二、熵和熵变 20分钟 熵(entropy)是体系或物质无序度或混乱度的量度。常用符号“S"表示。熵 (entropy)是体系或物质所具有的一种特性。高度无序的体系或物质
10 课程名称 无机化学 授课专业及层次 临床药学本科 授课内容 第二章第二、三节 学时数 2 教学目的 掌握热效应的计算;判断化学反应方向。 重 点 Hess 定律 难 点 掌握热效应的计算 自学内容 无 使用教具 黑板、多媒体教学课件 相关学科知识 数学 教 学 法 启发式教学 讲授内容纲要、要求及时间分配 复习上节课内容 四、反应热的计算 ·盖斯定律(重点掌握) 一个化学反应不管是一步完成或是几步完成,它的反应热都是相同的。 这就是著名的 Hess 定律。只对等容过程或等压过程才适用。 ·标准摩尔生成焓 热力学规定:在指定的温度下,由稳定单质生成 1mol 物质 B 时的焓变, 称为物质 B 的摩尔生成焓,用符号“ΔfHm”表示,单位为 kJ·mol-1。 如果反应是在标准状态下进行的,物质 B 的摩尔生成焓,就称为标准摩 尔生成焓,用符号“ΔfHm ”表示。 并规定:最稳定单质的标准生成焓为零。 §2.3 化学反应的方向性 一、自发过程 自发过程是在一定条件下不需要任何外力就能自动进行的过程。 二、熵和熵变 熵(entropy)是体系或物质无序度或混乱度的量度。常用符号“S”表示。熵 (entropy)是体系或物质所具有的一种特性。高度无序的体系或物质 10 分钟 10 分钟 15 分钟 10 分钟 20 分钟

姓名孙红2010~201L学年第一学期时间20101030 节次7-8 熵值高;而讲然有序的体系或物质,熵值低。 熵是状态函数,体系所处的状态不同,熵值也不同。 0K时,任何纯物质完整晶体的熵值等于零。S0=0 △S=S终-S始 在标准状态和指定的温度下,1ol物质所具有的熵值,称为标准熵,用符 号“Sm"表示,单位为Jmol-1K-l。标准熵是标准状态下物质的绝对熵值。 和焓变(△H)的计算类似,在标准状态下和298K时,由标准摩尔熵Sm⊕ 的数值计算标准摩尔熵变△rSm⊕: △,S=∑S(生成物)-∑S(反应物) 三、吉布斯能 15分钟 在热力学中,用吉布斯能来表示在等温等压下体系做功的能力,定义 式为: G=H-TS ·吉布斯能与自发过程 由最稳定单质生成1ol物质B时的吉布斯能变化,称为物质B的摩 尔生成自由能。 在标准状态下的物质B的摩尔生成自由能,称为物质B的标准摩尔生 成吉布斯能,用符号“△Gm表示,单位为kJ-mol-1。 热力学上规定稳定单质的△Gm为零。 吉布斯能判据 课后习题P3812、13、15 20分钟
11 姓名_孙红_ 2010 ~ 2011 学年第 一 学期 时间_ 2010.10.30 节次_7-8_ 熵值高;而井然有序的体系或物质,熵值低。 熵是状态函数,体系所处的状态不同,熵值也不同。 0K 时,任何纯物质完整晶体的熵值等于零。S0=0 ΔS = S 终–S 始 在标准状态和指定的温度下,1mol 物质所具有的熵值,称为标准熵,用符 号“Sm ”表示,单位为 J·mol-1·K-1。标准熵是标准状态下物质的绝对熵值。 和焓变(ΔH)的计算类似, 在标准状态下和 298K 时,由标准摩尔熵 Sm 的数值计算标准摩尔熵变ΔrSm : 三、吉布斯能 在热力学中,用吉布斯能来表示在等温等压下体系做功的能力,定义 式为: G=H-TS ·吉布斯能与自发过程 由最稳定单质生成 1mol 物质 B 时的吉布斯能变化,称为物质 B 的摩 尔生成自由能。 在标准状态下的物质 B 的摩尔生成自由能,称为物质 B 的标准摩尔生 成吉布斯能,用符号“ΔfGm θ”表示,单位为 kJ·mol-1。 热力学上规定稳定单质的“ΔfGm θ”为零。 吉布斯能判据 课后习题 P38 12、13、15 15 分钟 20 分钟 = (生成物) − (反应物) r m m Sm S v S v i i