
教 案 姓名:董丽花2009~2010学年第一学期时间101210.13节次1-23-45-6 课程名称 无机化学 授课专业及层次 临床药学本科医学检验本+专 授课内容 第六章第一节第二节 学时数 2 教学目的 了解氧化数和离子电子法配平氧化还原反应方程式的方法, 重点 掌握电极电势的产生和确定, 难点 掌握电极电势的产生和确定, 自学内容 氧化数法配平氧化还原反应方程式的方法: 使用教具 多媒体 相关学科 无 知识 教学法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 5 min 第六章氧化还原 §6.1氧化还原反应的实质 一、氧化与怀原 ·氧化还原反应 ·半反应和氧化还原电对 半反应的通式为: 氧化态+ne一还原态 10 min 或Ox+ne=Red 氧化还原电对:氧化态/还原态(Ox/Red) 二、元素的氧化数 某元素一个原子的电荷数,这种电荷数是将成键电子指定给电负性较 大的原子而求得。 三、氧化还原方程式的配平 ·氧化数法 ·离子电子配平法 §6.2电池的电动势和电极电势 一、原电池与电极 由正极反应和负极反应所构成的总反应,称为电池反应
教 案 姓名:董丽花 2009~2010 学年第 一 学期时间 10.12/10.13_节次_1-2/3-4/5-6 复习上节课内容 第六章 氧化还原 §6.1 氧化还原反应的实质 一、氧化与还原 ·氧化还原反应 ·半反应和氧化还原电对 半反应的通式为: 氧化态 + ne 还原态 或 Ox + ne Red 氧化还原电对:氧化态/还原态(Ox/Red) 二、元素的氧化数 某元素一个原子的电荷数,这种电荷数是将成键电子指定给电负性较 大的原子而求得。 三、氧化还原方程式的配平 ·氧化数法 ·离子电子配平法 §6.2 电池的电动势和电极电势 一、原电池与电极 由正极反应和负极反应所构成的总反应,称为电池反应。 5 min 10 min 课程名称 无机化学 授课专业及层次 临床药学本科 医学检验本+专 授课内容 第六章 第一节 第二节 学时数 2 教学目的 了解氧化数和离子电子法配平氧化还原反应方程式的方法, 重 点 掌握电极电势的产生和确定, 难 点 掌握电极电势的产生和确定, 自学内容 氧化数法配平氧化还原反应方程式的方法; 使用教具 多媒体 相关学科 知识 无 教 学 法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配

讲授内容纲要、要求及时间分配(附页) 为了书写方便,原电池常用电池组成式表示 如:C-Zn原电池的组成式为: 20 min (-)Zn|Zn2+(c1)IlCu2+(c2)|Cu(+) 组成式的书写规定: ·电极的类型 金属-金属离子电极 如:锌电极金属-金属难溶盐-阴离子电极 如:氯化银电极 氧化还原电极 15 min 如:Fe3+/Fe2+电极 体-离子电极 如:氯气电极 二、电极电势 (一)电极电势的产生 原因:双电层理论 15 min 由于双电层的建立在金属电极与金属离子溶液之间产生的电势差, 称金属的平衡电极电势,简称电极电势。其大小与金属的本性、温度和 金属离子的浓度有关。 (二)标准电极电势 ·标准氢电极 电极电势的绝对值还无法直接测定,实际中使用的是相对值,即以 某一特定电极的电极电位作参照,其他任何电极的电极电位通过与这个 参照电极组成原电池来确定。IUPAC的规定,以标准氢电极为参照,它的 15min 电极电势规定为零 ·标准电极电势 在标准状态下,测定的相对电极电势,称为标准电极电势,用符号“E” 表示,单位为V。 ·标准电极电势表 将测得的各种氧化还原电对的标准电极电势,按一定的方式汇集在 起,就构成了标准电极电势表
讲授内容纲要、要求及时间分配(附页) 为了书写方便,原电池常用电池组成式表示 如:Cu-Zn 原电池的组成式为: (–)Zn | Zn2+(c1)|| Cu 2 +(c2)| Cu(+) 组成式的书写规定: ·电极的类型 金属-金属离子电极 如:锌电极金属-金属难溶盐-阴离子电极 如:氯化银电极 氧化还原电极 如:Fe3+/Fe2+电极 气体-离子电极 如:氯气电极 二、电极电势 (一)电极电势的产生 原因:双电层理论 由于双电层的建立在金属电极与金属离子溶液之间产生的电势差, 称金属的平衡电极电势,简称电极电势。其大小与金属的本性、温度和 金属离子的浓度有关。 (二)标准电极电势 ·标准氢电极 电极电势的绝对值还无法直接测定,实际中使用的是相对值,即以 某一特定电极的电极电位作参照,其他任何电极的电极电位通过与这个 参照电极组成原电池来确定。IUPAC 的规定,以标准氢电极为参照,它的 电极电势规定为零。 ·标准电极电势 在标准状态下,测定的相对电极电势,称为标准电极电势,用符号“Eθ” 表示,单位为 V。 ·标准电极电势表 将测得的各种氧化还原电对的标准电极电势,按一定的方式汇集在一 起,就构成了标准电极电势表。 20 min 15 min 15 min 15min

讲授内容纲要、要求及时间分配(附页) (三)标准电极电势表的应用 ()根据电极电位的高低,可以判断氧化还原能力的相对强弱。 20 min Ew值越高,表示(Ox/Red)中,Ox得电子的能力越强,是较强 的氧化剂;Ey值越低,表示(Ox/Red)中,Red失电子的能力越强 是较强的还原剂。 较强的氧化剂其对应的还原剂的还原能力较弱 较强的还原剂其对应的氧化剂的氧化能力较弱 (2)判断氧化还原反应进行的方向 Ey=E+y-E-w>0正向自发进行 EW =E+W E-W<O 正向非自发进行 EV=E+V-E-V=0反应达到平衡 作业: 1、复习本节课内容 2、P130:1、2
讲授内容纲要、要求及时间分配(附页) (三)标准电极电势表的应用 (1) 根据电极电位的高低,可以判断氧化还原能力的相对强弱。 E 值越高,表示(Ox / Red)中, Ox 得电子的能力越强,是较强 的氧化剂; E 值越低,表示(Ox / Red)中, Red 失电子的能力越强, 是较强的还原剂。 较强的氧化剂其对应的还原剂的还原能力较弱 较强的还原剂其对应的氧化剂的氧化能力较弱 (2) 判断氧化还原反应进行的方向 E = E+ – E–>0 正向自发进行 E = E+ – E–<0 正向非自发进行 E = E+ – E– = 0 反应达到平衡 作业: 1、复习本节课内容 2、P130:1、2 20 min
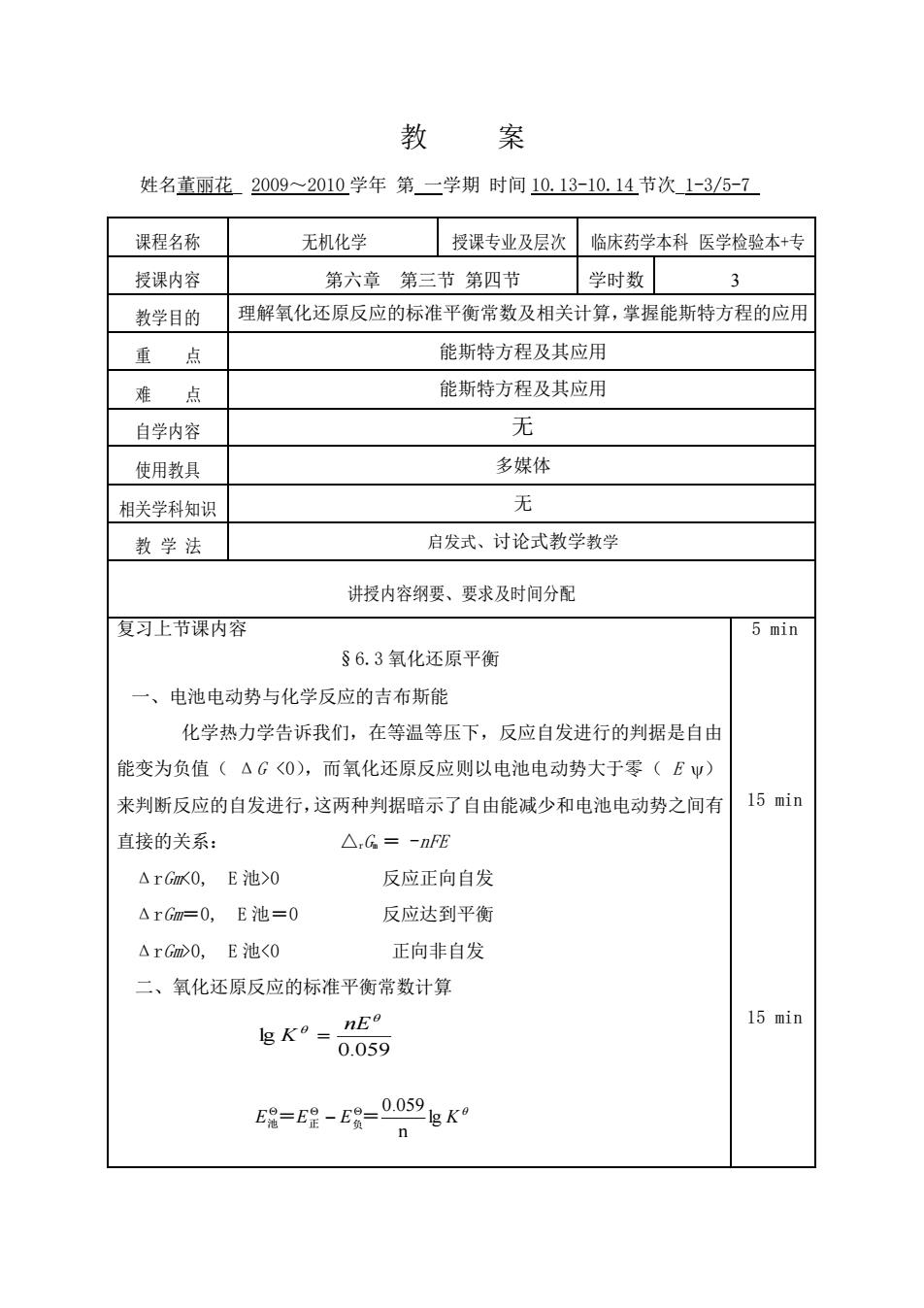
教案 姓名董丽花2009~2010学年第二学期时间10.13-10.14节次1-3/5-7 课程名称 无机化学 授课专业及层次临床药学本科医学检验本+专 授课内容 第六章第三节第四节学时数3 教学目的 理解氧化还原反应的标准平衡常数及相关计算,掌握能斯特方程的应用 重点 能斯特方程及其应用 难点 能斯特方程及其应用 自学内容 无 使用教具 多媒体 相关学科知识 无 教学法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 5 min §6.3氧化还原平衡 一、电池电动势与化学反应的吉布斯能 化学热力学告诉我们,在等温等压下,反应自发进行的判据是自由 能变为负值(△G<0),而氧化还原反应则以电池电动势大于零(EΨ) 来判断反应的自发进行,这两种判据暗示了自由能减少和电池电动势之间有 15 min 直接的关系: △,G=-nFE △rGx0,E池>0 反应正向自发 △rGm=0,E池=0 反应达到平衡 △rGm>0,E池<0 正向非自发 二、氧化还原反应的标准平衡常数计算 15 min 5g=E2-ER-0059gK n
教 案 姓名董丽花_ 2009~2010 学年 第 一学期 时间 10.13-10.14 节次_1-3/5-7_ 课程名称 无机化学 授课专业及层次 临床药学本科 医学检验本+专 授课内容 第六章 第三节 第四节 学时数 3 教学目的 理解氧化还原反应的标准平衡常数及相关计算,掌握能斯特方程的应用 重 点 能斯特方程及其应用 难 点 能斯特方程及其应用 自学内容 无 使用教具 多媒体 相关学科知识 无 教 学 法 启发式、讨论式教学教学 讲授内容纲要、要求及时间分配 复习上节课内容 §6.3 氧化还原平衡 一、电池电动势与化学反应的吉布斯能 化学热力学告诉我们,在等温等压下,反应自发进行的判据是自由 能变为负值( ΔG <0),而氧化还原反应则以电池电动势大于零( E ) 来判断反应的自发进行,这两种判据暗示了自由能减少和电池电动势之间有 直接的关系: △rGm = -nFE ΔrGm<0, E 池>0 反应正向自发 ΔrGm=0, E 池=0 反应达到平衡 ΔrGm>0, E 池<0 正向非自发 二、氧化还原反应的标准平衡常数计算 5 min 15 min 15 min 0.059 lg nE K = E E E lg K n 0.059 池 = 正 − 负 =

讲授内容纲要、要求及时间分配(附页) §6.4影响电极电势的因素 、能斯特方程式:对于任意一个已配平的氧化还原方程式 a0x1+bRed2 ==dRed]e0x2 30min 使用Nernst方程式的几点说明: 1.n表示电极反应中电子转移的个数。 2.cox和cred应包括氧化剂和还原剂及其相关介质,但纯液体、纯固体和 溶剂不写入方程中。 3.若为气体则用分压除以100kPa表示。 4.ā、b分别表示一个已配平的氧化还原半反应中氧化态和还原态各物质前 的系数。 二、溶液酸度对电极电势的影响 例题解析 25min 溶液酸度不仅对电对的电极电势产生影响,有时还能改变氧化剂的还原产 物: 三、加入沉淀剂对电极电势的影响 在一个氧化还原体系中加入能与氧化剂或还原剂发生反应生成沉淀的试 剂,会导致其浓度降低,从而改变电对的电极电势。不同的沉淀剂,生成的 30min 沉淀不同,Ks即不同,电极电势的改变值亦不同。 加入的沉淀剂若与氧化型物质反应生成沉淀,电对的电极电势将降低: 若是与还原型物质反应生成沉淀,电对的电极电势值将升高。 例题解析 30min 作业: 1、复习本节课内容 2、P131:4、5
讲授内容纲要、要求及时间分配(附页) §6.4 影响电极电势的因素 一、能斯特方程式:对于任意一个已配平的氧化还原方程式 aOx1 + bRed2 === dRed1 + eOx2 使用 Nernst 方程式的几点说明: 1. n 表示电极反应中电子转移的个数。 2.cox 和 cred 应包括氧化剂和还原剂及其相关介质,但纯液体、纯固体和 溶剂不写入方程中。 3.若为气体则用分压除以 100kPa 表示。 4.a、b 分别表示一个已配平的氧化还原半反应中氧化态和还原态各物质前 的系数。 二、溶液酸度对电极电势的影响 例题解析 溶液酸度不仅对电对的电极电势产生影响,有时还能改变氧化剂的还原产 物; 三、加入沉淀剂对电极电势的影响 在一个氧化还原体系中加入能与氧化剂或还原剂发生反应生成沉淀的试 剂,会导致其浓度降低,从而改变电对的电极电势。不同的沉淀剂,生成的 沉淀不同,Ksp 不同,电极电势的改变值亦不同。 加入的沉淀剂若与氧化型物质反应生成沉淀,电对的电极电势将降低; 若是与还原型物质反应生成沉淀,电对的电极电势值将升高。 例题解析 作业: 1、复习本节课内容 2、P131:4、5 30min 25min 30min 30min b d a Ox Ox d Ox d c c nF RT E E ( ) ( ) ln Re ( /Re ) ( /Re ) = +