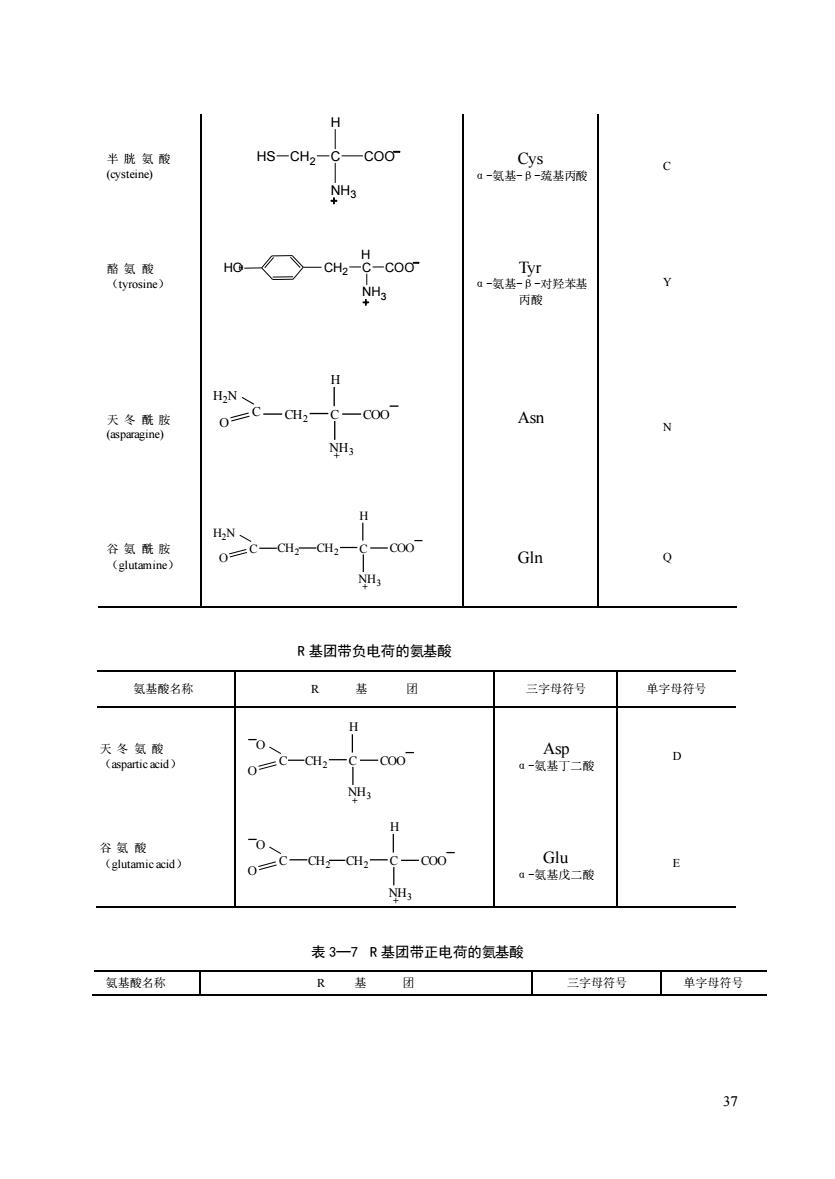
HS -CH NH3 HO -CH-cod NH3 丙酸 不冬酰 0 -00 Asn H N 0=0 000 Gln R基团带负电荷的氨基酸 氨基酸名称 R 基 团 三字母符号 单字母符号 H 。-智二酸 0 。G-R NH 表3一7R基团带正电荷的氨基酸 氨基酸名称 R基 团 三字母符号单字母符号
37 半 胱 氨 酸 (cysteine) Cys α-氨基-β-巯基丙酸 C 酪 氨 酸 (tyrosine) Tyr α-氨基-β-对羟苯基 丙酸 Y 天 冬 酰 胺 (asparagine) + CH2 C H NH3 C COO H2N O Asn N 谷 氨 酰 胺 (glutamine) + CH2 C H NH3 C COO H2N O CH2 Gln Q R 基团带负电荷的氨基酸 氨基酸名称 R 基 团 三字母符号 单字母符号 天 冬 氨 酸 (aspartic acid) + CH2 C H NH3 C COO O O Asp α-氨基丁二酸 D 谷 氨 酸 (glutamic acid) + CH2 C H NH3 C COO O CH2 O Glu α-氨基戊二酸 E 表 3—7 R 基团带正电荷的氨基酸 氨基酸名称 R 基 团 三字母符号 单字母符号 C H COO NH3 HS CH2 HOH C COO NH3 CH2 H
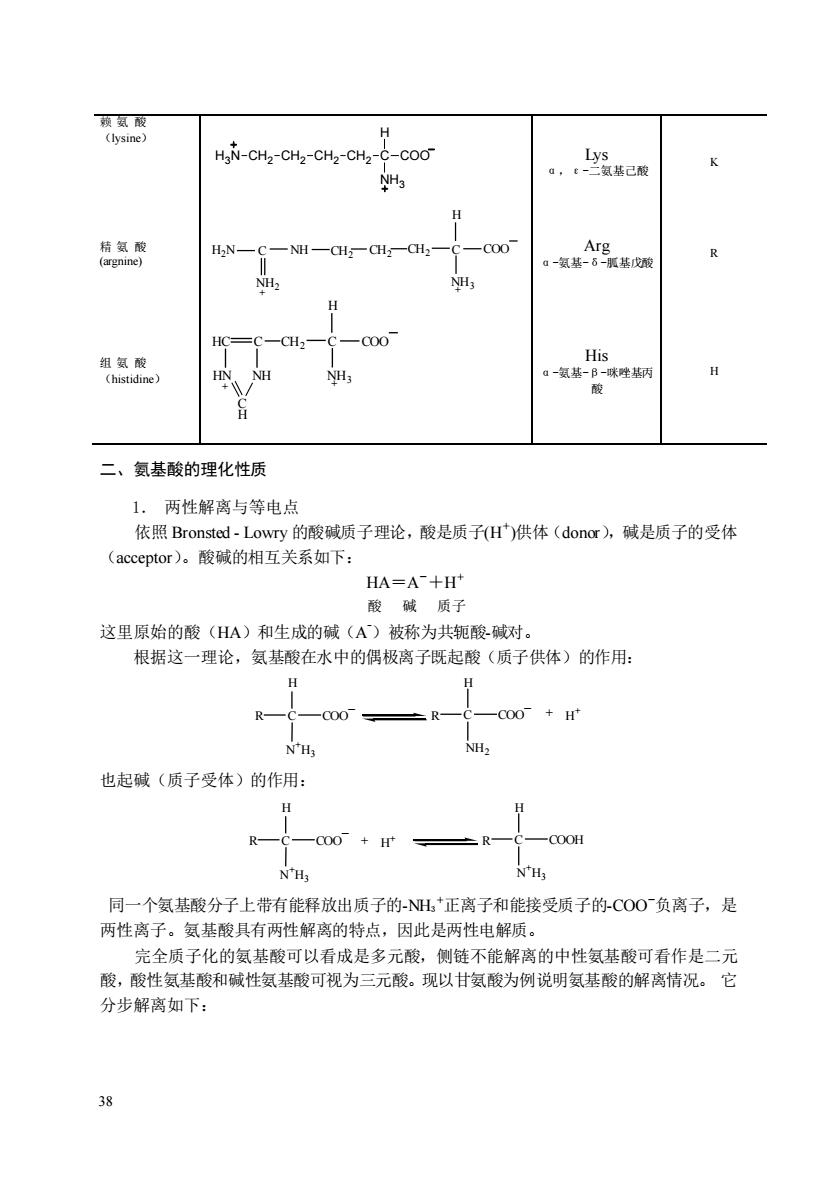
HaN-CH2-CH2-CHz-CH2-C-COO N NHs 。,己 HN- 一NH一CH一CH一aH -c00 CH. -00 -氨 二、氨基酸的理化性质 1.两性解离与等电点 依照Bronsted-Lowry的酸碱质子理论,酸是质子(H)供体(donor),碱是质子的受体 (acceptor)。酸碱的相互关系如下: HA=A十H 酸碱质子 这里原始的酸(HA)和生成的碱(A)被称为共轭酸碱对。 根据这一理论,氨基酸在水中的偶极离子既起酸(质子供体)的作用: H 00+H nH NH2 也起碱(质子受体)的作用: R 000H N'Hg 同一个氨基酸分子上带有能释放出质子的H正离子和能接受质子的CO0负离子,是 两性离子。氨基酸具有两性解离的特点,因此是两性电解质。 完全质子化的氨基酸可以看成是多元酸,侧链不能解离的中性氨基酸可看作是二元 酸,酸性氨基酸和碱性氨基酸可视为三元酸。现以甘氨酸为例说明氨基酸的解离情况。它 分步解离如下:
38 赖 氨 酸 (lysine) Lys α,ε-二氨基己酸 K 精 氨 酸 (argnine) + CH2 C H NH3 CH CH2 COO C NH 2 NH2 H2N + Arg α-氨基-δ-胍基戊酸 R 组 氨 酸 (histidine) + CH2 C H NH3 HC C COO HN NH + C H His α-氨基-β-咪唑基丙 酸 H 二、氨基酸的理化性质 1. 两性解离与等电点 依照 Bronsted - Lowry 的酸碱质子理论,酸是质子(H+ )供体(donor),碱是质子的受体 (acceptor)。酸碱的相互关系如下: HA=A -+H + 酸 碱 质子 这里原始的酸(HA)和生成的碱(A -)被称为共轭酸-碱对。 根据这一理论,氨基酸在水中的偶极离子既起酸(质子供体)的作用: R C H N +H3 COO _ NH2 + H + R C H COO _ 也起碱(质子受体)的作用: R C H N +H3 COO _ N +H3 + H + R C H COOH 同一个氨基酸分子上带有能释放出质子的-NH3 +正离子和能接受质子的-COO-负离子,是 两性离子。氨基酸具有两性解离的特点,因此是两性电解质。 完全质子化的氨基酸可以看成是多元酸,侧链不能解离的中性氨基酸可看作是二元 酸,酸性氨基酸和碱性氨基酸可视为三元酸。现以甘氨酸为例说明氨基酸的解离情况。 它 分步解离如下: C H COO NH3 H3N CH2 CH2 CH2 CH2
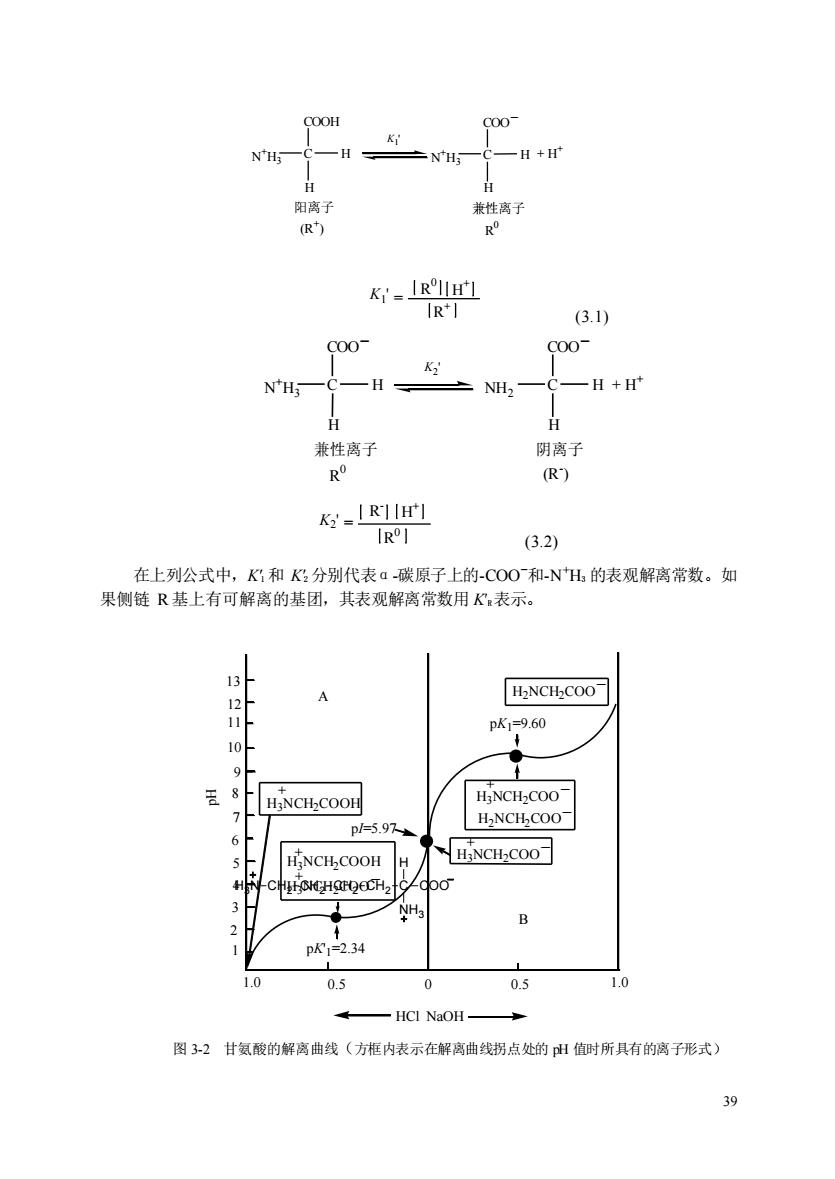
K'-IRHH'] R (3.1) c00 c00 NH; -H NH2 一H+H 兼性离子 阴离子 R (R) K=IR1IH (3.2) 在上列公式中,K?和K分别代表a碳原子上的-CO0和-NH的表观解离常数。如 果侧链R基上有可解离的基团,其表观解离常数用K表示。 H2NCH2COO 11 pK1=9.60 8 HNCH-COOH HaNCH-COO p/.9 HNCHCOOH H HiNCH-COO -C doo pK12.34 1.0 0.5 0 0.5 1.0 HCI NaOH. 图3-2甘氨酸的解离曲线(方框内表示在解离曲线拐点处的出值时所具有的离子形式)
39 (R + ) N +H C H 3 COOH _ + H + H 阳离子 N +H C H 3 COO H 兼性离子 R 0 K1 ' K1 ' = R 0 H + R + (3.1) (R - ) NH C H 2 COO _ + H + H 阴离子 N +H C H 3 COO H 兼性离子 R 0 K2 ' _ K2 ' = H + R 0 R - (3.2) 在上列公式中,K′1 和 K′2 分别代表α-碳原子上的-COO-和-N +H3 的表观解离常数。如 果侧链 R 基上有可解离的基团,其表观解离常数用 K′R表示。 1 2 3 4 5 6 7 8 9 10 11 12 13 1.0 0.5 0 0.5 1.0 H2NCH2COO - H3NCH2COO - H2NCH2COO - + H3NCH2COO - H3NCH2COOH + + H3NCH2COOH + H3NCH2COO + - pK1=9.60 pI=5.97 pK'1=2.34 A B HCl NaOH pH 图 3-2 甘氨酸的解离曲线(方框内表示在解离曲线拐点处的 pH 值时所具有的离子形式) C H COO NH3 H3N CH2 CH2 CH2 CH2

为了判断滴定曲线上的两个拐点,pH值234和9.60究竟代表甘氨酸中哪个基团的解 离,可以把它们与脂肪酸和脂肪胺的pK值进行对比。脂肪酸中的一COOH基pK值一般 在4~5,脂肪胺中的NH的pK值一般在9~10。所以最可能的是pK'=2.34代表甘氨 酸中一COOH基的解离,pK=9.60代表甘氨酸中一NH基的解离。甘氨酸钟的一COOH 基的酸性要比醋酸pK=476)强100多倍,这是因为邻近的一NH基的正电荷对一COOH 的质子(H产生静电排斥因而增强了一COOH基释放质子的趋势,用下式表示: H H 一CO0H= H一C一CO0+ NH3 NH◆正电荷彼此排拆 含一氨基一羧基和不解离R基的氨基酸都具有类似甘氨酸的滴定曲线。这类氨基酸的 pK值相当于pk的范围为20一30,pk为90~10.0(见表38).带有可解离R基的氨 基酸,相当于三元酸,有三个pK值,因此滴定曲线比较复杂。 图中曲线A和B之间的拐点(l=5.97就是甘氨酸处于净电荷为墨时的pH值,称为签 电点(isoelectric point,缩写为p山或等电H值p)(在某一PH值时,氨基酸所带的静 电荷,在电场中既不向阴极移动,也不向阳极移劲,此时氨基酸所处溶液的PH值称 为该氨基酸的等电点)。在等电山值时,氨基酸在电场中既不向正极也不向负极移动,即 处于兼性离子(极少数为中性分子)状态,少数离子成阳离子和阴离子,但解离成阳离子和 阴离子的数目相等。 对侧链R基不解离的中性氨基酸来说,其等电点是它的pK和pK:的算术平均值。 pI=(pK'+pkz) 在等电点以上的任何H值,氢基酸带净负电荷,并因此在电场中向正极移动。在低 于等电点的:一pH值,氨基酸带有净正电荷,在电场中向负极移动。在一定pH值范围 内,氨基酸溶液的pH值高等电点越远,氨基酸所携带的净电荷越大。 0≥c-a4,-000 NH; H HaN-CH2-CH2-CHz-CHz-C-COO N 对于多元酸只要依次写出它从酸性至中性至碱性解离过程的各种离子形式,取两性
40 为了判断滴定曲线上的两个拐点,pH 值 2.34 和 9.60 究竟代表甘氨酸中哪个基团的解 离,可以把它们与脂肪酸和脂肪胺的 pK′值进行对比。脂肪酸中的—COOH 基 pK′值一般 在 4~5,脂肪胺中的—N +H3 的 pK’值一般在 9~10。所以最可能的是 pK1’=2.34 代表甘氨 酸中—COOH 基的解离,pK2′=9.60 代表甘氨酸中—N +H3 基的解离。甘氨酸中的—COOH 基的酸性要比醋酸(pK′=4.76)强 100 多倍,这是因为邻近的—N +H3基的正电荷对—COOH 的质子(H+ )产生静电排斥因而增强了—COOH 基释放质子的趋势,用下式表示: 含一氨基一羧基和不解离 R 基的氨基酸都具有类似甘氨酸的滴定曲线。这类氨基酸的 pK′值相当于 pK1′的范围为 2.0~3.0,pK2′为 9.0~10.0 (见表 3-8)。带有可解离 R 基的氨 基酸,相当于三元酸,有三个 pK′值,因此滴定曲线比较复杂。 表 图中曲线 A和 B之间的拐点(pI=5.97)就是甘氨酸处于净电荷为零时的 pH值,称为等 电点(isoelectric point,缩写为 pI)或等电 pH 值(pHI)(在某一 PH 值时,氨基酸所带的静 电荷为零,在电场中既不向阴极移动,也不向阳极移动,此时氨基酸所处溶液的 PH 值称 为该氨基酸的等电点)。在等电pH 值时,氨基酸在电场中既不向正极也不向负极移动,即 处于兼性离子(极少数为中性分子)状态,少数离子成阳离子和阴离子,但解离成阳离子和 阴离子的数目相等。 对侧链 R 基不解离的中性氨基酸来说,其等电点是它的 pKl′和 pK2′的算术平均值。 pI = 1 2 (pK1 ' + pK2 ') 在等电点以上的任何 pH 值,氨基酸带净负电荷,并因此在电场中向正极移动。在低 于等电点的任一 pH 值,氨基酸带有净正电荷,在电场中向负极移动。在一定 pH 值范围 内,氨基酸溶液的 pH值离等电点越远,氨基酸所携带的净电荷越大。 + CH2 C H NH3 C COO O O 对于多元酸只要依次写出它从酸性至中性至碱性解离过程的各种离子形式,取两性 H C H N +H3 COOH _ N +H3 + H + H C H COO 正电荷彼此排斥 C H COO NH3 H3N CH2 CH2 CH2 CH2

离子两侧的pK值的平均值即为该氨基酸的值。 20种基本氨基酸,除组氨酸外,在生理pH值(pH值为7左右)下都没有明显的缓冲容 量。因为这些氨基酸的pk值都不在pH值7附近(表38,而缓冲容量只在接近pk值时才 显现出来。从表38和图32可见,组氨酸咪唑基的p.值为6.0,在pH值为7附近有明 显的缓冲作用。 1.吸收光谱 参与蛋白质组成的20种氨基酸,在可见光区域都没有光吸收,但在远紫外区域<220 nm均有光吸收。在近紫外区域(220~300nm)只有酪氨酸、苯丙氨酸和色氨酸有吸收光的 能力。因为它们的R基含有苯环共轭双锭系统。酪氨酸的最大光吸收波长在275m,苯 丙氨酸的在257nm,色氨酸的在280nm。 蛋白质由于含有这些氨基酸,因此也有紫外吸收能力。 一般最大光吸收在波长280m 处,因此利用分光光度法能很方便地测定蛋白质的含量。但是在不同的蛋白质中这些氨基 酸的含量不同,所以它们的消光系数(或称吸收系数)是不完全一样的。 3.重要化学反应 氨基酸的化学反应主要是指它的α-氨基和α-羧基以及侧链上的功能团所参与的那些 反应。 皮巴亮高致出 NH2 OH R—CH-COOH+HNO2→R—CH-COOH+N2↑+H2O 在标准条件下测定生成的氮气体积,即可计算出氨基酸的量,用此方法反应很快,也 较为准确,是定量测定氨基酸的方法之一(此反应是Vanslyke氢基氮测定法的基础)。此 法还可用于蛋白质水解程度的测定。 这里值得注意的是生成的氮气)只有一半来自氨基酸。此外应该指出,除āNH外, 赖氨酸的e-NH也能与亚硝酸反应,但速度较慢。而a-NH2作用3~4min即完成反应。 (2)与2,4二硝基氯的反应在弱碱性溶液中,氨基酸的ā·氨基很容易与2, 4二硝基氟苯(DNFB)作用,生成稳定的黄色2,4二硝基苯基氨基酸(简写为DNP.氨 基酸)。 02N 〉F+N-d一OOH当虫0N -COOH HF NO2 NO, (DNFB) DNP氨基酸(黄色) 这个反应首先被英国的Sanger用来鉴定多肽或蛋白质的N末瑞氨基酸。 (3)与异疏氯酸苯酯反应在弱碱性条件下,氨基酸中的α氨基还可以与异硫氰酸 苯酯(PTC)反应,产生相应的苯氨基硫甲酰氨基酸(PTC氨基酸)。在无水酸中,PTC 氨基酸即环化为苯硫乙内酰脲(PTH),后者在酸中极稳定
41 离子两侧的 pK1 值的平均值即为该氨基酸的 pI 值。 20 种基本氨基酸,除组氨酸外,在生理 pH 值(pH 值为 7 左右)下都没有明显的缓冲容 量。因为这些氨基酸的pK′值都不在 pH 值 7 附近(表 3-8),而缓冲容量只在接近 pK′值时才 显现出来。从表 3-8 和图 3-2 可见,组氨酸咪唑基的 pK′R 值为 6.0,在 pH值为 7附近有明 显的缓冲作用。 1. 吸收光谱 参与蛋白质组成的 20 种氨基酸,在可见光区域都没有光吸收,但在远紫外区域(<220 nm 均有光吸收。在近紫外区域(220~300 nm)只有酪氨酸、苯丙氨酸和色氨酸有吸收光的 能力。因为它们的 R 基含有苯环共轭双键系统。酪氨酸的最大光吸收波长在 275 nm,苯 丙氨酸的在 257 nm,色氨酸的在 280 nm。 蛋白质由于含有这些氨基酸,因此也有紫外吸收能力。一般最大光吸收在波长 280 nm 处,因此利用分光光度法能很方便地测定蛋白质的含量。但是在不同的蛋白质中这些氨基 酸的含量不同,所以它们的消光系数(或称吸收系数)是不完全一样的。 3. 重要化学反应 氨基酸的化学反应主要是指它的-氨基和α-羧基以及侧链上的功能团所参与的那些 反应。 (1) 与亚硝酸反应 在室温下亚硝酸能与含游离α-氨基的氨基酸起反应,定量 地放出 氮气,氨基酸被氧化成羟酸(含亚氨基的脯氨酸则不能与亚硝酸反应)。其反应式如下: 在标准条件下测定生成的氮气体积,即可计算出氨基酸的量,用此方法反应很快,也 较为准确,是定量测定氨基酸的方法之一(此反应是 Vanslyke 氨基氮测定法的基础)。此 法还可用于蛋白质水解程度的测定。 这里值得注意的是生成的氮气(N2)只有一半来自氨基酸。此外应该指出,除α-NH2 外, 赖氨酸的ε-NH2也能与亚硝酸反应,但速度较慢。而α-NH2 作用 3~4min 即完成反应。 (2)与 2,4-二硝基氟苯的反应 在弱碱性溶液中,氨基酸的α- 氨基很容易与 2, 4-二硝基氟苯(DNFB)作用,生成稳定的黄色 2,4-二硝基苯基氨基酸(简写为 DNP-氨 基酸)。 F NO2 O2N CH COOH R N NO2 O2N H CH COOH R + H2N 弱碱中 + HF (DNFB) DNP-氨基酸(黄色) 这个反应首先被英国的 Sanger 用来鉴定多肽或蛋白质的 N 末端氨基酸。 (3)与异硫氰酸苯酯反应 在弱碱性条件下,氨基酸中的α-氨基还可以与异硫氰酸 苯酯(PITC)反应,产生相应的苯氨基硫甲酰氨基酸(PTC-氨基酸)。在无水酸中,PTC- 氨基酸即环化为苯硫乙内酰脲(PTH),后者在酸中极稳定。 R CH NH2 COOH R CH OH + HNO2 COOH+ N2 + H2O