
(二)盐类 1.氯化亚铜 氯化亚钥是一种白色晶体,熔点为430℃, 难溶于水,吸湿后变为绿色,溶于氨水。 在热的浓盐酸溶液中,用钥粉还原CuC2, 生成无色的[CuC1],用水稀释即可得到难溶于 水的CuCI白色沉淀: Cu2+Cu+2C1△ 2Cucl CuC】的盐酸溶液能吸收CO,形成氯化羰基 铜(1)[CuCl(CO)]·HO,此反应在气体中用于测 定混合气体中CO的含量
无机化学 (二) 盐类 1. 氯化亚铜 氯化亚铜是一种白色晶体,熔点为 430 ℃, 难溶于水,吸湿后变为绿色,溶于氨水。 在热的浓盐酸溶液中,用铜粉还原 CuCl2, 生成无色的 [CuCl2 ] -,用水稀释即可得到难溶于 水的 CuCl 白色沉淀: CuCl 的盐酸溶液能吸收 CO,形成氯化羰基 铜(Ⅰ) [CuCl(CO)] ·H2O,此反应在气体中用于测 定混合气体中CO 的含量。 2+ Cu + Cu + 2Cl 2CuCl − △ ↓

2.氯化铜 无水氯化铜为棕黄色晶体,在空气中潮解,它 易溶于水,也易溶于乙醇和丙酮。从溶液中结晶出 的二水合氯化铜为蓝色晶体。 CuC溶液浓度不同时,溶液呈现的颜色也不 同。很浓的CuC,溶液呈黄绿色,浓溶液呈绿色, 稀溶液呈蓝色。[CuCL4]2呈黄色,[Cu(HO)4]2呈 蓝色,当两种配离子共存时溶液呈黄绿色或绿色。 氯化铜可用氧化铜与盐酸反应制得。CuC)是 共价化合物,与碱金属卤化物或盐酸发生反应,生 成[CuCL4]2配离子。由于[CuCL4]2不够稳定,只 能在C过量时形成。 CuC2加热至773K时,分解为CuCl和Cl20
无机化学 2. 氯化铜 无水氯化铜为棕黄色晶体,在空气中潮解,它 易溶于水,也易溶于乙醇和丙酮。从溶液中结晶出 的二水合氯化铜为蓝色晶体。 CuCl2 溶液浓度不同时,溶液呈现的颜色也不 同。很浓的 CuCl2 溶液呈黄绿色,浓溶液呈绿色, 稀溶液呈蓝色。[CuCl4] 2-呈黄色,[Cu(H2O)4] 2-呈 蓝色,当两种配离子共存时溶液呈黄绿色或绿色。 氯化铜可用氧化铜与盐酸反应制得。CuCl2 是 共价化合物,与碱金属卤化物或盐酸发生反应,生 成 [CuCl4] 2-配离子。由于[CuCl4] 2- 不够稳定,只 能在 Cl- 过量时形成。 CuCl2 加热至 773 K 时,分解为 CuCl 和 Cl2

3.硫酸钥 五水合硫酸铜俗称胆矾或蓝矾。CuSO4·5H2O 是蓝色晶体,受热后逐步脱水,最后生成无水硫酸 钥: CuS04·5H,0375KCuS04·3H,0386KCuS04·H,031KCuS0
无机化学 3. 硫酸铜 五水合硫酸铜俗称胆矾或蓝矾。CuSO4 · 5H2O 是蓝色晶体,受热后逐步脱水,最后生成无水硫酸 铜: CuSO 5H O CuSO 3H O CuSO H O 4 2 4 2 4 2 4 CuSO 375 K 386 K 531 K

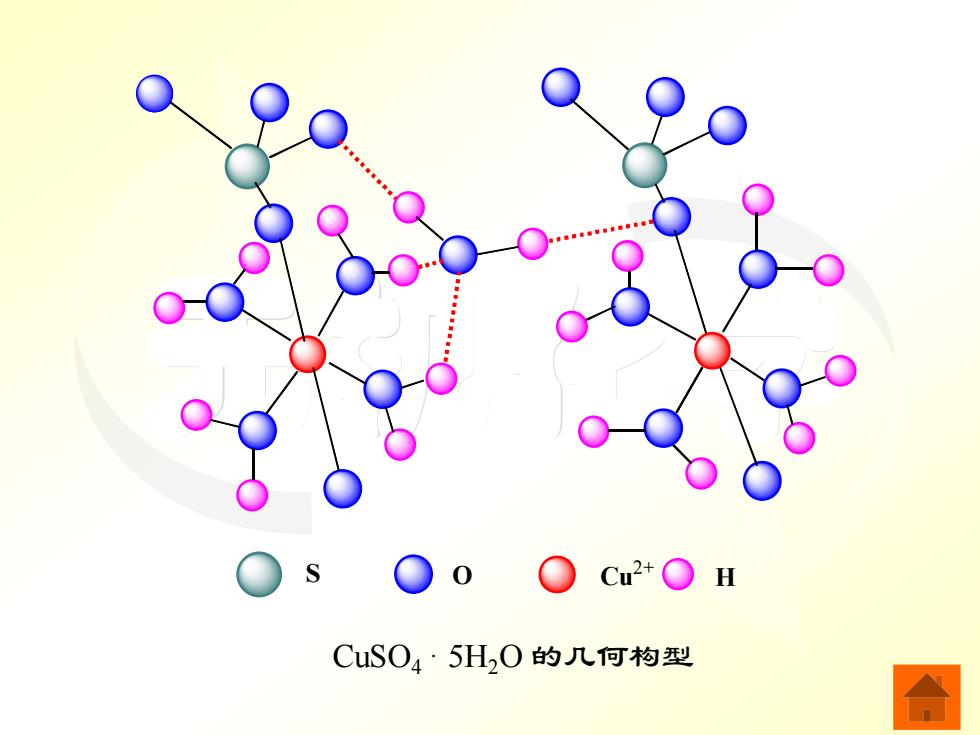
在CuSO4·5H,O中,五个H0的结合力是不 同的。其中四个H0和两个SO}位于变形八面体 的六个顶点,四个H0处于平面正方形的四个角 上,两个S0位于平面正方形的上方和下方,第 五个H0以氢键与两个配位H20和两个S0}结 合。加热时,先失去两个非氢键水分子,再失去 另外两个氢键水分子,最后失去以氢键与$0?结 合的水分子
无机化学 在 CuSO4 · 5H2O 中,五个 H2O 的结合力是不 同的。其中四个H2O 和两个 位于变形八面体 的六个顶点,四个 H2O 处于平面正方形的四个角 上,两个 位于平面正方形的上方和下方,第 五个 H2O 以氢键与两个配位 H2O 和两个 结 合。加热时,先失去两个非氢键水分子,再失去 另外两个氢键水分子,最后失去以氢键与 结 合的水分子。 2 SO4 − 2 SO4 − 2 SO4 − 2 SO4 −
Cu2+○H CuSO4·5H,O的几何构型
无机化学 CuSO4 · 5H2O 的几何构型 S O Cu 2+ H