
篇 生物大分子的结构与功能 本篇主要涉及生物机体重要生物大分子的结构与功能,包括蛋白质、核酸和酶等内 容,共3章。 机体是由数以亿万计分子量大小不等的分子组成。参与机体构成并发挥重要生理功 能的生物大分子尽管分子很大,但通常都由一定的种类不多的小分子基本结构单位组成 并按一定的排列顺序和连接方式而形成多聚体。 蛋白质是体内主要的生物大分子。机体的各项功能、各种性状都是由种类繁多、特定 的蛋白质分子来实现。酶是一类具有催化功能的重要蛋白质分子,体内几乎所有的化学 反应都由特定的酶来催化,使机体的物质代谢得以顺利进行。 核酸是体内另一类重要的生物大分子,具有储存和传递遗传信息等功能。核酸和蛋 白质两类生物大分子相互配合,使遗传信息得以表达,是生长、繁殖、物质代谢等生命现象 的基础。 学习本篇内容时,应首先认识体内上述生物大分子的结构特性、功能,重点是结构与 功能的关系,为后续内容的学习打下基础。 5

第一章蛋自质的结构与功能 学习目 通过本章的学习,你应该能够: 掌握蛋白质的元素组成特点,等电点概念。蛋白质一级结构的概念及其主要 的化学健,蛋白质三级结构的概念和维持其稳定的化学键。蛋白质一级 结构与高级结构以及功能三者之间的关系并能举例说明。蛋白质变性的 将令及其在医学卜的应用 熟悉蛋白质二级结构的概念、主要化学键及二级结构的主要形式。蛋白质别 构效应的概念。蛋白质的两性电离特性和等电点的概念,蛋白质的胶体 性质及其稳定因素,紫外吸收特性。 了解氨基酸的结构特点和分类,氨基酸的常见理化性质,包括两性电离、紫外 吸收特性和茚三酮显色反应等。肽、肽键与肽链的概念,多肽链的写法 几种重要的生物活性肽。蛋白质的分类。α-螺旋、B折叠、B转角和不规 则卷曲的结构特点,模序的概念。结构域、分子伴侣的概念。蛋白质四级 结构的概念和维持其稳定的化学键、亚基的概念。分子病、蛋白质构象疾 病的概念及分子机制,血红蛋白和肌红蛋白的分子结构。蛋白质复性、凝 固的概念,蛋白质的呈色反应。常用的蛋白质分离纯化技术。 蛋白质(protein)是细胞组分中含量最丰富,功能最多的生物大分子物质,也是生命活动的重要物 质基础。人体内蛋白质约占固体成分的45%,约有十万余种。各种蛋白质的分子结构千差万别,决 定了蛋白质功能的多样性,从而担负起参与并完成以复杂的物质代谢为基础的生命活动重任。生物 体内的酶、若干凝血因子、抗体、肽类激素、转运蛋白、收缩蛋白、基因调控蛋白等都是蛋白质,但结 构与功能截然不同。它们在物质代谢、血液凝固、机体防御、生长发育、物质转运、肌肉收缩、信号 转导等方面发挥着不可替代的重要作用。蛋白质之所以具有如此复杂重要的功能与蛋白质的结 构关系密切。本章将主要阐述蛋白质的结构特征,蛋白质结构与功能的关系,以及蛋白质重要的 理化性质。 第一节蛋白质的分子组成 一、蛋白质的元素组成 尽管蛋白质的种类繁多,结构各异,但元素组成相似,主要有碳(50%~55%)、氢(6%~7%)、氧
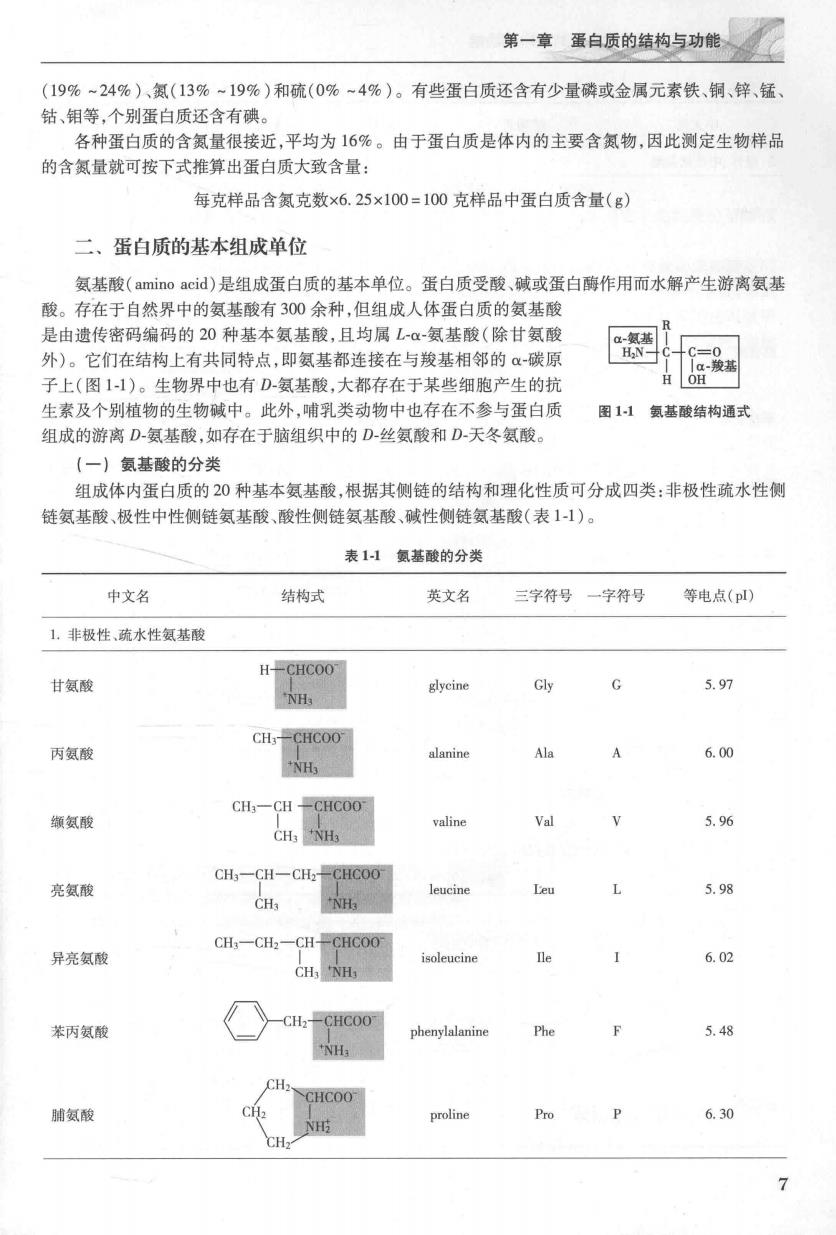
第一章蛋白质的结的与功能 (199%~24%)、氮(13%~19%)和硫(0%~4%)。有些蛋白质还含有少量磷或金属元素铁、铜、锌、锰 钴、钼等,个别蛋白质还含有碘。 各种蛋白质的含氮量很接近,平均为16%。由于蛋白质是体内的主要含氮物,因此测定生物样品 的含氮量就可按下式推算出蛋白质大致含量: 每克样品含氮克数×6.25×100=100克样品中蛋白质含量(g) 二、蛋白质的基本组成单位 氨基酸(amino acid)是组成蛋白质的基本单位。蛋白质受酸、碱或蛋白酶作用而水解产生游离氨基 酸。存在于自然界中的氨基酸有300余种,但组成人体蛋白质的氨基酸 是由遗传密码编码的20种基本氨基酸,且均属L-α-氨基酸(除甘氨酸 外)。它们在结构上有共同特点,即氨基都连接在与羧基相邻的α-碳原 子上(图11)。生物界中也有D-氨基酸,大都存在于某些细胞产生的抗 生素及个别植物的生物碱中。此外,哺乳类动物中也存在不参与蛋白质 图11氨基酸结构通式 组成的游离D氨基酸,如存在于脑组织中的D-丝氨酸和D-天冬氨酸。 (一)氨基酸的分类 组成体内蛋白质的20种基本氨基酸,根据其侧链的结构和理化性质可分成四类:非极性疏水性侧 链氨基酸、极性中性侧链氨基酸、酸性侧链氨基酸、碱性侧链氨基酸(表1-1)。 表11氨基酸的分类 中文名 结构式 英文名 三字符号一字符号 等电点(pl) 1非极性、疏水性氨基酸 甘氨酸 H-CHCOO glycine Gly 5.97 丙氨酸 CH-CHCOO alanine Ala A 6.00 NH、 CH:-CH -CHCOO 缬氨酸 valine 5.96 CH3-CH-CHz-CHCOO 亮氨酸 leucine Leu L 5.9 CH NH CH3-CH2-CH-CHCOO 异亮氨酸 isoleucine 6.02 苯丙氨酸 -CH2-CHCOO phenylalanine Phe F 5.48 NH. CHCOO 脯氨酸 proline Pro 6.30 CH

第一篇生物大分子的结构与功能 续表 中文名 结构式 英文名三字符号一字符号等电点(p) 2.极性、中性氨基酸 色氨酸 HO-CH 丝氨酸 serine 5.68 酪氨酸 -CH:-CHCOO Tyr 5.6 HS-CH2-CHCOO 半胱氨酸 cysteine 5.0m CH:SCHCH -CHCOO 蛋氨酸 methionine Me 5.74 -CH 天冬酰胺 asparagine Asn 5.41 谷氨酰胺 -CHCOO glutamine 5.6的 苏氨酸 560 3.酸性氨基酸 天冬氨酸 HOOCCH -CHCOO aspartie acid NH Asp D 2.97 HOOCCH-CH2-CHCOO 谷氨酸 glutamic acid Glu 32 NH 4.碱性氨基酸 NH-CH.CH.CH.CHz -CHCOO 赖氨酸 lysine 9.74 NH 精氨酸 NHCNHCH.CH.CH arginine 10.76 -CH:CHCOO 组氨酸 histidine His H 7.59

第一章蛋白质的结构与功能 1.非极性疏水性氨基酸这类氨基酸的侧链R基团为非极性,具有大小不一的疏水性,在水溶液 中的溶解度小于极性中性氨基酸 2.极性中性氨基酸这类氨基酸的侧链上有轻基或硫基、酰被基等极性基团,具有亲水性,但在中 性水溶液中侧链R基团不解离。 3.酸性氨基酸 酸性氨基酸的R基团含有羧基,易解离出H而具有酸性 4.碱性氨基酸碱性氨基酸的R基团含有氨基、胍基或咪唑基。这些基团质子化而使分子带正 电荷 此外,在蛋白质翻译后的修饰过程中一些氨基酸残基被修饰,脯氨酸和赖氨酸可被修饰成羟明氨酸 和羟赖氨酸,它们存在于骨胶原和弹性硬蛋白质中。2个半胱氨酸通过脱氢后可以二硫键相结合,形成 胱氨酸。蛋白质中有不少半胱氨酸以胱氨酸形式存在。蛋白质分子中氨基酸残基的某些基团还可被甲 基化、甲酰化、乙酰化、异戊二烯化和磷酸化等。这些翻译后修饰,可改变蛋白质的溶解度、稳定性、亚细 胞定位和与其他细胞蛋白质的相互作用的性质等,体现了蛋白质生物多样性的一个方面 (二)氨基酸的理化性质 1.氨基酸两性解离和第由点由干所有氨基酸都含有碱性的氨基和酸性的龄基.可在酸性 液中与质子(H)结合呈带有正电荷的阳离子(一NH,*),也可在碱性溶液中与0H结合,失去质子变成 带负电荷的阴离子(一C00),因此氨基酸是一种两性电解质,具有两性解离的特性。氨基酸的解离方 式取决于其所处溶液的pH值。在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相 等,成为兼性离子,呈电中性,此时溶液的pH称为该氨基酸的等电点(isoelectric point,pl)(图1-2)。 H-NH,K)OH R ECH一NH OO 围12氨基酸的解离通式 氨基酸的pl是由a羧基和&-氨基的解离常数的负对数pK,和pK,决定的。pl计算公式为:pl=l/2 (pK,+pK,)。如丙氨酸pK,=2.34,DK,=9.69,所以pl=1/2(2.34+9.69)=6.02。若1个氨基酸有3个 可解离基团,写出它们电离式后取兼性离子两边的K值的 平均值,即为此氨基酸的pl值。 2.紫外吸收性质色氨酸、酪氨酸和苯丙氨酸因含有共 轭双键,可在波长250~290m处有特征紫外吸收峰。在中性 pH条件下,色氨酸、酪氨酸的最大吸收峰在280m处,而苯丙 氨酸最大吸收蜂在260nm处(图1-3)。由于色氨酸对280nm 光吸收的强度大约是酪氨酸和苯丙氨酸的十倍,因此色氨酸 对蛋白质溶液在280m的吸光度贡就最大。又由于大多数蛋 白质都含有芳香族氨基酸,所以测定蛋白质溶液280mm的光 吸收值,是分析溶液中蛋白质含量的快速简便的方法。 3.茚三酮反应(ninhydrin reaction)氨基酸与茚三j 水合物共加热,茚三酮水合物被还原,其还原物可与氨基酸 10 加热分解产生的氨结合,再与另一分子茚三酮缩合成为蓝 200 紫色的化合物.此化合物最大吸收峰在570m被长处。由 波长(nm》 于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此 图13色氨酸、酪氨酸和苯丙 可作为氨基酸定性和定量分析方法。 氨酸的紫外吸收