
第三章酶与维生素 学习目标 通过本章的学习,你应该能够: 掌握酶的概念与化学本质,酶活性中心的概念,酶催化作用的特点,底物浓度 对酶促反应影响的米氏方程,Km和Vmax的概念及其意义,不可逆性抑制 的概念、特点与常见实例,可逆性抑制的概念,竞争性抑制的概念、特点与 常见实例,别构调节与共价修饰调节的概念与作用特点,酶原及酶原激活 的概念,维生素的概念与分类。 熟悉常见辅酶或辅基的种类,维生素与常见辅助因子的对应关系,必需基团的 概念及其作用,酶浓度、温度、pH、激活剂对酶促反应的影响,最适温度和 最适pH的概念,酶原激活的过程与生理意义,常见水溶性维生素和脂溶 性维生素的来源、生理功能和缺乏症。 了解单纯酶、全酶、酶蛋白、酶的辅助因子、辅酶和辅基的概念,辅酶或辅基的 作用,同工酶的概念,同工酶的实例,酶专一性的分类,酶促反应高效性的 机制,酶区域化分布的意义,酶的催化机制,Km和Vmx的测定方法,不可 逆性抑制与变性的区别,非竞争性抑制与反竞争性抑制的概念,常见的激 活剂,酶活性及酶活性单位的概念,别构酶的概念与动力学特点,酶含量 的调节方式,酶的分类与命名,酶与医学的关系,常见水溶性维生素和脂 溶性维生素的结构特点。 生物体内的新陈代谢是一切生命活动的基础。新陈代谢过程是通过各种化学反应有序进行 来实现的。这些化学反应有条不紊地进行依赖于生物体内存在的一类极为重要的生物催化剂(b ocatalyst)一酶(enzyme)的催化作用。酶是对特异底物(substrate)起高效催化作用的一类生物催 化剂。酶的化学本质大多为蛋白质。有少数酶是核酸,譬如核酶(ibozyme)的化学本质就是 RNA. 现代自然科学对酶的研究得益于对发酵机制的探索。1850年法国科学家Louis Pasteur提出发酵是 活酵母细胞的生理活动。1897年德国科学家Edward Buchner利用酵母提取液实现了无酵母细胞的发 酵,证实了酵母中生物催化剂的存在。1926年美国生物化学家James Sumner首次从刀豆中分离结晶出 脲酶,并首次证明了脲酶的化学本质为蛋白质。此后发现的酶均证明其化学本质为蛋白质。因此,人们 一直认为生物催化剂的化学本质为蛋白质。20世纪80年代,Sidney Altman和Thomas Cech等人发现某 些核酸也具有催化功能,提出了核酶的概念,进一步扩展了生物催化剂的范围。 47

第一篇生物大分子的结构与功能 第一节酶的分子结构与功能 酶与普通蛋白质一样,具有相应的一、二、三级结构,部分酶还有四级结构。由一条多肽链构成的仅 具有三级结构的酶称为单体酶(monomeric enzyme)。由多个相同或不同的亚基以非共价键连接组成的 酶称为寡聚酶(oligomeric enzyme)。几种具有不同催化功能的酶彼此聚合形成多酶复合物(multienzym: complex)或称多酶体系(multienzyme system)。催化相关代谢反应的酶组成的多酶体系有利于提高物质 代谢速率和调节效率。有些多酶体系由于在进化过程中基因的融合,多种不同催化功能存在于一条多 肽链中,这类酶称为多功能酶(multifunctional enzyme)或串联酶(tandem enzyme)。多酶复合物和多功能 酶都有利于提高物质代谢的速率和调节效率。 、酶的分子组成 根据酶的分子组成,酶可分为单纯酶(simple enzyme)和结合酶(conjugated enzyme)。仅由氨基酸残 基组成的酶称为单纯酶,如脲酶、淀粉酶、核糖核酸酶、尿酸酶等。结合酶是由蛋白质部分和非蛋白质部 分共同组成,结合酶的蛋白质部分称为酶蛋白(a即oenzyme),非蛋白质部分称为辅助因子(cofactor)。酶 蛋白与辅助因子结合形成的复合物称为全酶(holoenzyme)。酶蛋白和辅助因子单独存在时均没有催化 活性,只有全酶才具有催化活性。酶蛋白主要决定酶催化反应的特异性,辅助因子主要决定酶催化反应 的性质和类型。 按辅助因子与酶蛋白结合的紧密程度与作用特点不同可将酶辅助因子分为辅酶(coenzym心)与辅基 (prosthetic group)两类。辅酶与酶蛋白的结合疏松,在不改变酶蛋白肽链结构且构象也无明显变化时, 可以通过透析或超滤等物理方法将其除去,从而使全酶活性降低直到消失。与此相反,辅基则与酶蛋白 的结合紧密,不能通过透析或超滤等物理方法将其除去。铺酶与班蛋白结合可逆,而辅基与酶蛋白结合 可逆性低,有些酶的辅基从全酶复合物中解离后,酶蛋白容易发生变性而失去活性 酶的辅助因子按化学本质可以分成金属离子和有机化合物两大类。金属离子是最常见的辅助因 子,包括K、Na、,Ca2、Cu2“(Cu)、Zn2“、Fe2“(Fe)、Mg2、Mn4等。约2/3的酶含有金属离子。金属辅 助因子的作用是多方面的,如传递电子稳定酶的构象、中和电荷等。有的金属离子与酶蛋白紧密结合, 在提取过程中不易丢失,这类酶称为金属酶(metalloenzyme),如黄嘌呤氧化酶、超氧化物歧化酶等。有 的金属离子虽为酶发挥活性所必需,但不直接与酶蛋白结合,而是通过底物相连接,这类酶称为金属激 活年(netal activated enzyme),如己糖激!、肌酸激率等 酶的有机辅助因子主要是一类化学性质较稳定的小分子物质,其主要作用是参与酶的催化过程,能 够在反应中传递电子、质子或某些基团。需要有机辅助因子的酶很多,但这些酶所需要的辅助因子种类 有限,主要是维生素及其代谢生成的衍生物(表3)。另外,某些醌类衍生物、卟啉环衍生物等也可作 为某些酶的辅助因子。 有些酶可同时含多种不同类型的辅助因子,如琥珀酸脱氢酶同时含有铁和下AD,细胞色素氧化酶同 时含有铜和血红素 表31主要有机辅助因子及其在催化中转移的基团 所含的维生素 辅酶或辅基(活性形式) 转移的基团 主要生化功能 维生素B,(硫胺素) TPP(焦磷酸硫胺素) 醛基 α-酮酸氧化脱羧酶的辅酶 维生素B,(核黄素)】 FMN(黄素单核苷酸】 氢(质子) 氧化还原酶的辅基,参与生物氧 FAD(黄素腺嘌吟二核苷酸) 化体系 48

第三章酶与维生素、 续表 所含的维生素 铺礁成铺基(括性形式) 转移的基团 主要生化功能 维生素PP(尼克酰胺】 NAD'(尼克酰胺腺嘌吟二核苷酸, 氢(质子) 辅酶) 维生素B 磷酸吡哆醛 氨基 氨基酸转氨酶的辅酶 磷酸吡哆胺 泛酸(遍多酸) CoA(辅酶A) 酰基 酰基转移酶的辅酶 ACP(酰基载体蛋白) 叶酸 FH,(四氢叶酸) 碳单位 碳单位转移酶的辅酶 生物素 生物索 二氧化碳 羧化酶的辅基 维生素B,(结胺素) 钴胺素轴德类 甲硫氨酸合成酶的辅酶,L甲基 丙二酰CoA变位酶的辅酶 硫辛酸 硫辛酸 酰基 二氢硫辛酸乙酰转移酶的辅酶 二、酶的活性中心 酶分子中有各种化学基团,但它们不一定都与酶的活性有关。其中一些与酶的活性密切相关的 化学基团称为酶的必需基团(essential group)。酶的某些必需基团在一级结构中可能相距很远,但在 空间结构上彼此靠近,组成具有特定空间结构的区域,能与底物特异地结合并催化底物转化为产物。 此区域称为酶的活性中心(active center)或活性部位(active site)。辅酶或辅基多参与酶活性中心的 组成。 有的必需基团位于酶活性中心内,有的必需基团位于酶活性中心外。位于酶活性中心内的必需基 团可按其作用分类。直接识别和结合底物,使底物与特定构象状态的酶形成复合物,这类必需基团称为 结合基团(binding group)。通过影响底物中某些化学键的稳定性,催化底物发生化学反应,从而促进底 物转变成产物,这类必需基团称为催化基团(catalytic group)。酶活性中心内的某些必需基团可同时具 有这两方面的功能。另外,酶活性中心内有些必需基团不直接参与对底物的结合或催化作用,却是维持 酶活性中心特有的空间构象所必需的,称为结构必需基团。在酶活性中心以外有一些基团也是酶发挥 活性所必需的,其作用主要是维持酶分子整体以及活性中心特有的空间构象,这类基团属于酶活性中心 外的必需基团(图31)。常见的酶的必需基团有组氨酸残基的咪唑基、丝氨酸残基的羟基、半胱氨酸残 基的巯基以及酸性氨基酸残基的羧基等。 酶的话性中心是酶分子中且有三维结构的区城.日多为氨基酸残基的疏水基闭形成的列肇成凹哈 深入到酶分子内部,形成硫水“口袋”。酶的活性中心具有精确构象,是酶发挥催化作用所必需的。同 时,酶活性中心的构象是动态结构,存在可变性即具有柔性。酶活性中心构象的柔性也是酶发挥催化作 用以及酶活性调节所必需的 三、同工酶 有些酶虽然其蛋白质一级结构存在差异,但酶活性中心的三维结构相同或相似,可以催化相同化学 反应。同工酶(isoenzyme)是指催化相同的化学反应,但酶蛋白分子结构、理化性质乃至免疫学性质不 同的一组酶。同工酶通常是由不同基因或等位基因编码的多肽链,或由同一基因转录生成的不同 9

第一篇生物大分子的结构与功 物 图31腾的活性中心 mRNA翻译生成的不同多肽链组成的酶。同工酶存在于同一个体的不同组织或同一细胞的不同亚细胞 结构中。这种组织特异性或亚细胞结构特异性的分布,使不同的组织器官和不同的亚细胞结构具有不 同的代谢特征。这为利用同工酶来诊断不同器官的疾病提供了理论依据。 同工酶在自然界很普遍。根据同工酶结构差异,可将同工酶分成单体同工酶(monomeric isoenzyme) 和寡聚体同工酶(oligomeric isoenzyme)。单体同工酶只有一条多肽链,其差异仅在于多肽链的氨基酸序 列有所不同。单体同工酶数目较少。红细胞磷酸酶、葡萄糖磷酸变位酶、腺苷脱氨酶、甘油磷酸激酶等 都是单体同工酶。寡聚体同工酶在亚基的种类或结构上有差异,数量较多。由不同亚基组成的寡聚体 称为杂化体。寡聚体同工酶主要是偶数亚基的同工酶,且亚基数目一般不多于四个,三亚基同工酶很 少。乳酸脱氢酶(lactate dehydrogenase,LDH)同工酶为四亚基,肌酸激酶(creatinekinase,CK)同工酶为 两亚基。LDH和CK都属于可形成杂化体的同工酶。 DH是四聚体酶,其亚基类型有骨骼肌型(M型)和心肌型(H型)。这两型亚基能够以不同的比例 组成五种同工酶(图3-2):LDH,(H)、LDH(HM)、LDH,(H,M2)、LDH,(HM)、LDH,(M)。LDH催化 乳酸与丙酮酸之间的氧化还原反应。因分子结构差异,这五种同工酶具有不同的电泳速率(在pH8.6 的缓冲液中进行电泳,电泳速率从1至5递减),对同一底物的亲和力不同(LDH,对乳酸的亲和力较大 而DH,对乳酸的亲和力较小)。体外催化反应时,LDH,的最适pH为9.8,LDH,的最适pH为7,8。 LDH同工酶中两种不同亚基的合成受不同基因的控制。因为不同组织器官合成这两种亚基的速率不 同以及两种亚基之间杂交情况不同,LDH同工酶在不同组织器官中的种类、含量和分布有明显差异(表 32)。这使不同的组织细胞具有不同的代谢特点 同工酶的测定已经应用于临床诊断。当某组织细胞发生病变时,该组织细胞特异的同工酶可能会 释放入血。因此同工酶谱的分析有助于疾病诊断。例如,正常人血清中LDH,的活性高于LDH.,而心 肌梗死患者血清中LDH,的活性大于DH2,肝病患者血清中DH,的活性明显升高(图33)。 8888888888 图32LDH的五种同工酶 50
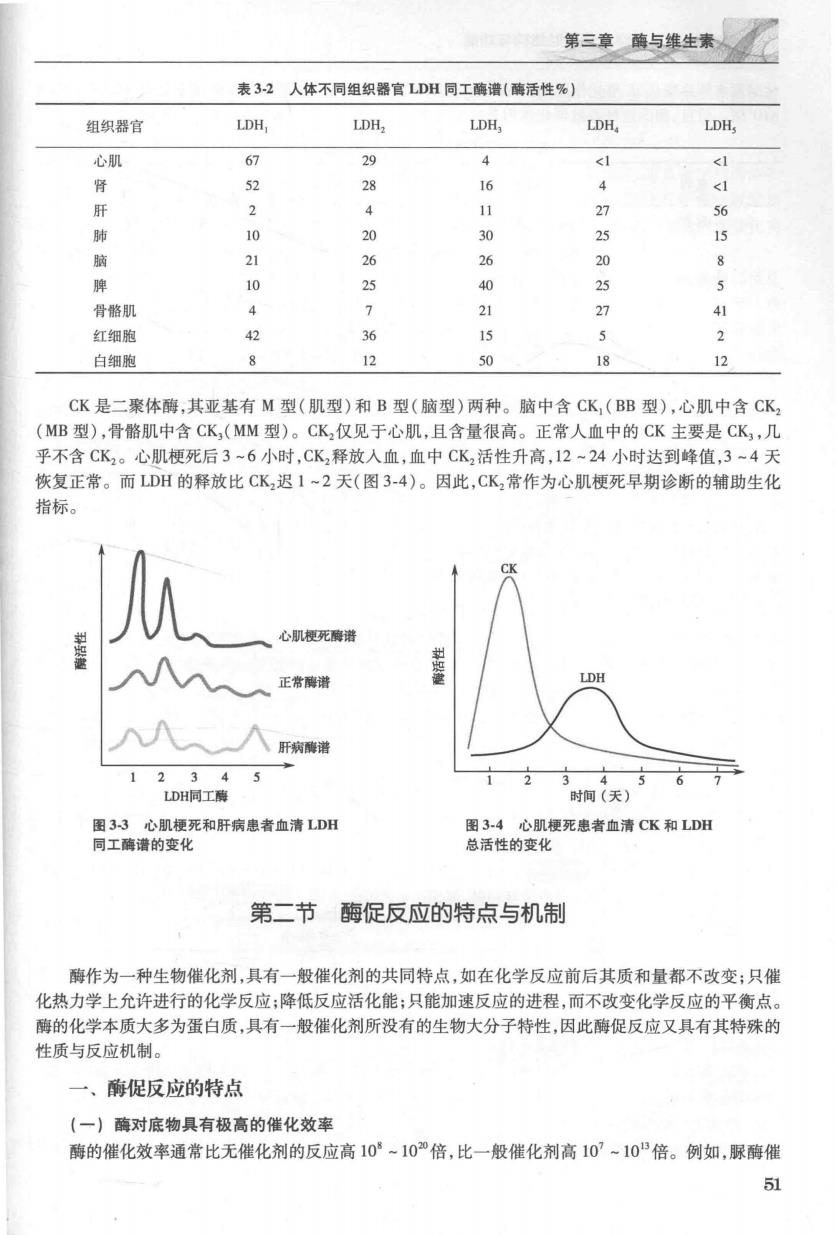
第三章酶与维生素人, 表32人体不同组织器官LDH同工酶谱(酶活性%) 组织器官 LDH, LDH, LDH, LDH, LDH, 心肌 4 d 28 16 4 肝 11 27 肺 10 20 25 15 脑 26 26 20 脾 40 25 骨酪肌 21 27 红细胞 为 36 15 5 3 白细胞 8 12 50 18 12 CK是二聚体酶,其亚基有M型(肌型)和B型(脑型)两种。脑中含CK(BB型),心肌中含CK (MB型),骨路肌中含CK,(MM型)。CK,仅见于心肌,日含量很高。正常人血中的CK主要是CK,几 乎不含CK2。心肌梗死后3~6小时,CK,释放入血,血中CK活性升高,12~24小时达到峰值,3~4天 恢复正常。而LDH的释放比CK迟1~2天(图3-4)。因此,CK2常作为心肌梗死早期诊断的辅助生化 指标」 、心肌授死酶诺 正常酶谢 12345 DH同工需 12 6 图3,3心肌梗死和肝病患者血清LDH 图34心肌梗死患者血清CK和LD阳 同工酶谱的变化 总活性的变化 第二节酶促反应的特点与机制 酶作为一种生物催化剂,具有一般催化剂的共同特点,如在化学反应前后其质和量都不改变:只催 化热力学上允许进行的化学反应;降低反应活化能:只能加速反应的进程,而不改变化学反应的平衡点。 酶的化学本质大多为蛋白质,具有一般催化剂所没有的生物大分子特性,因此酶促反应又具有其特殊的 性质与反应机制。 一、酶促反应的特点 (一】酶对底物具有极高的催化效率 酶的催化效率通常比无催化剂的反应高10°-10”倍,比一般催化剂高10-10倍。例如,脲酶催