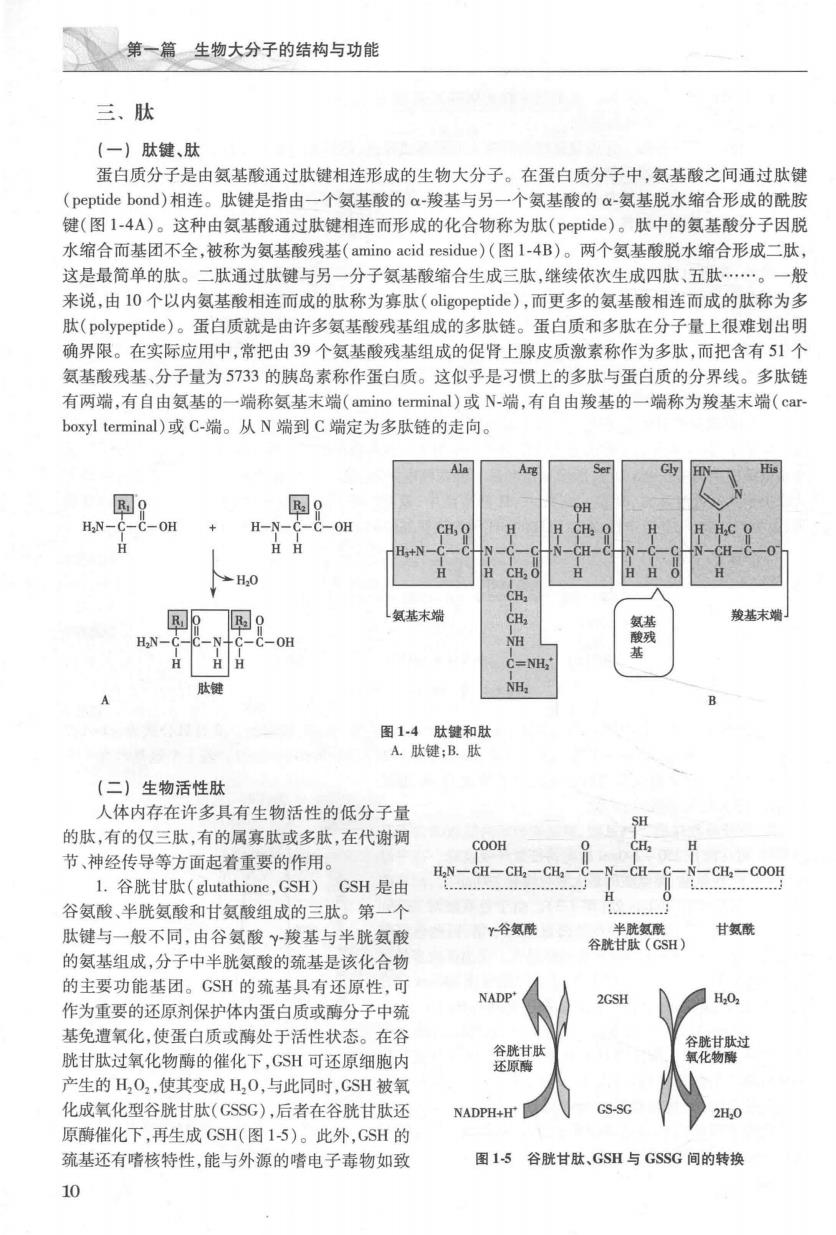
第一篇生物大分子的结构与功能 三、肽 (一)肽键、肽 蛋白质分子是由氨基酸通过肽键相连形成的生物大分子。在蛋白质分子中,氨基酸之间通过肽键 (peptide bond)相车。肽键是指由一个氨基酸的a-羧基与另一个氨基酸的a-氨基脱水缩合形成的酰胺 键(图1-4A)。这种由氨基酸通过肽键相连而形成的化合物称为肽(peptide)。肽中的氨基酸分子因脱 水缩合而基团不全,被称为氨基酸残基(amino acid residue)(图1-4B)。两个氨基酸脱水缩合形成二肽, 这是最简单的肽。二肽通过肽键与另一分子氨基酸缩合生成三肽,继续依次生成四肽、五肽. 来说,由10个以内氨基酸相连而成的肽称为寡肽(oligopeptide),而更多的氨基酸相连而成的肽称为多 肽(polypeptide)。蛋白质就是由许多氨基酸残基组成的多肽裤。蛋白质和多肽在分子量上很难划出明 确界限。在实际应用中,常把由39个氨基酸残基组成的促肾上腺皮质激素称作为多肽,而把含有51个 氨基酸残基、分子量为5733的胰岛素称作蛋白质。这似乎是习惯上的多肽与蛋白质的分界线。多肽链 有两端,有自由氨基的一端称氨基末端(amin ninal)或N-端,有自由羧基的一端称为羧基未端(car boxyl terminal)或C-端。从N端到C端定为多肽链的走向。 Ala Ser G R.o HN-C-C-OH R.9 氨基末端 肽 图14肚键和肽 A.肽键:B.肽 (二)生物活性肚 人体内存在许多具有生物活性的低分子量 的肽,有的仅三肽,有的属寡肽或多肽,在代谢调 COOH 节、神经传导等方面起着重要的作用。 HN一CH一CH,一CH -CH:-COOH L.谷胱甘肽(glutathione,GsH)GSH是由 谷氨酸、半胱氨酸和甘氨酸组成的三肽。第一个 肽键与一般不同,由谷氨酸Y羧基与半胱氨酸 Y谷氨配 谷甘《C) 甘氨酰 的氨基组成,分子中半胱氨酸的疏基是该化合物 的主要功能基闭。GSH的硫基具有还原性,可可 作为重要的还原剂保护体内蛋白质或酶分子中颈 NADP- 2GSH 基免遗氧化,使蛋白质或酶处于活性状态。在谷 胱甘肽过氧化物酶的催化下,GSH可还原细胞内 产生的H,O2,使其变成H,0,与此同时,CSH被氧 化成氧化型谷胱甘肽(GSSG),后者在谷胱甘肽还 NADPH+H GS-SG 2H,0 原酶催化下,再生成GSH(图15)。此外,GSH的 巯基还有嗜核特性,能与外源的嗜电子毒物如致 图15谷胱甘肽GSH与GSSG间的转换

第一章蛋白质的结构与功能 癌剂或药物等结合,从而阻断这些化合物与DNA、RNA或蛋白质结合,以保护机体免遭毒物损害。 2.多肽类激素及神经肽体内有许多激素属寡肽或多肽,例如属于下丘脑垂体肾上腺皮质轴的 催产素(9肽)、加压素(9肽)、促肾上腺皮质激素(39肽)、促甲状腺素释放激素(3肽)等。体内有一类 在神经传导程中起信县转导作用的肽米被弥为神经肽(neuropeptide)。较早发现的有脑啡肽(5肽) B-内啡肽(31肽)和强啡肽(17肽)等。近年还发现孤啡肽(17肽),其一级结构类似于强啡肽。它们与 中枢神经系统产生痛觉抑制有密切关系,因此很早就被用于临床的镇痛治疗。除此以外,神经肽还包括 P物质(10肽)、神经肽Y等。随着脑科学的发展,相信将发现更多的在神经系统中起着重要作用的生 物活性肽或蛋白质。 第二节蛋白质的分子结构 人体内具有生理功能的蛋白质都有特定结构,即一定的氨基酸百分组成和氨基酸排列顺序,以及肽 链空间的特定构象。因此蛋白质分子结构能够真正体现蛋白质的个性,是每种蛋白质具有独特生理功 能的结构基础。 一、蛋白质的一级结构 在蛋白质分子中,从N-端至C-端的氨基酸排列顺序称为蛋白质的一级结构(primar町y structure)。这 种顺序由DNA中基因的碱基序列所决定。一级结构中的主要化学键是肽键。1953年英国化学家F©d erick Sanger完成测定牛胰岛素的一级结构,牛胰岛素有A和B二条多肽链,A链有21个氨基酸残基,B 链有30个。分子中有3个二硫键,1个位于A链内,另2个二硫键位于A,B两链间(图1-6)。 - 6 腾米假天碳行酸女亮考甘-丝组亮-数谷-丙亮丽-宠多甘谷 精-甘-苯-苯-酪-苏-脯-婉-苏-0H 图16牛胰岛素的一级结构 一级结构是蛋白质空间构象和特异生物学功能的基础。随着蛋白质结构研究的深入,人们已认识 到蛋白质一级结构并不是决定蛋白质空间构象的唯一因素。肽链的正确折叠和正确高级构象形成需要 分子伴侣等分子参与。 二、蛋白质的空间结构 蛋白质的空间构象(conformation)是指蛋白质分子中的每一原子在三维空间的相对位置,它们是蛋 白质分子特有性质和功能的结构基础。蛋白质空间结构包括二级、三级、四级结构。由一条肽链形成的 蛋白质只有一级、二级和三级结构,由二条或二条以上多肽链形成的蛋白质才可能具有四级结构。 (一)蛋白质的二级结构 蛋白质的二级结构(secondar y structure)是指蛋白质分子中某一段肽链的局部空间结构,也就是该 段肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。肽链主链骨架原子即N(氨基 氮),C(α-碳原子)和C.(羰基碳)3原子依次重复排列。蛋白质的二级结构仅涉及主链构象而不涉及 R侧链的空间排布。 11
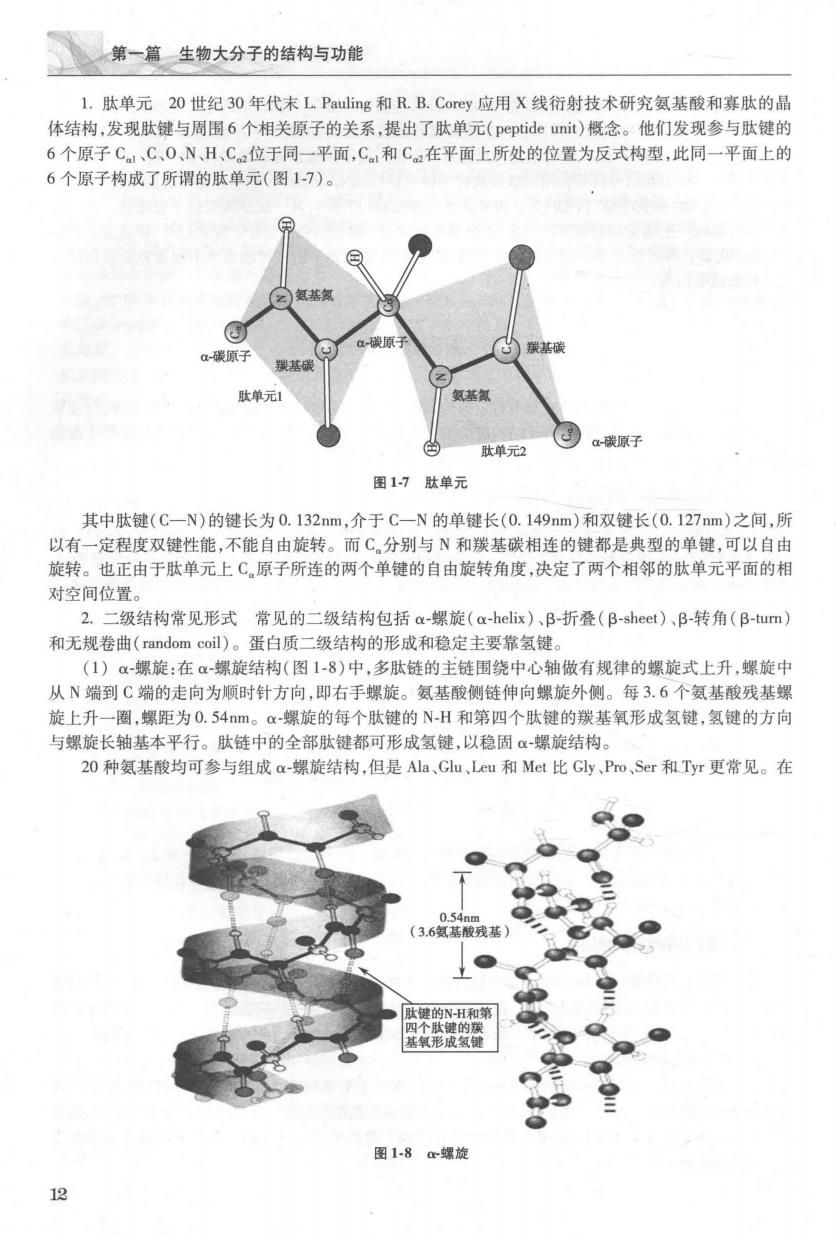
第一意生物大分子的结构与功能 1.肽单元20世纪30年代末L Pauling和R.B.Corey应用X线行射技术研究氨基酸和寒肽的晶 体结构,发现肽键与周围6个相关原子的关系,提出了肽单元(p©eptide unit)概念。他们发现参与肽键的 6个原子C、C、0、NH,C位于同一平面,C和Ca在平面上所处的位置为反式构型,此同一平面上的 6个原子构成了所谓的肽单元(图1-7)。 色肽单元 )a-碳原子 图17肽单元 其中肽键(C-N)的键长为0.132nm,介于C-N的单键长(0.149mm)和双键长(0.127mm)之间,所 以有一定程度双键性能,不能自由旋转。而C,分别与N和羰基碳相连的键都是典型的单键,可以自由 旋转。也正由于肽单元上C原子所连的两个单键的自由旋转角度,决定了两个相邻的肽单元平面的相 对空间位置。 2.二级结构常见形式常见的二级结构包括a-螺旋(a-helix)、B-折叠(B-sheet)、B-转角(B-tum) 和无规卷曲(random coil)。蛋白质二级结构的形成和稳定主要靠氢键 (1)α螺旋:在α螺旋结构(图1-8)中,多肽链的主链围绕中心轴做有规律的螺旋式上升,螺旋中 从N端到C端的走向为顺时针方向,即右手螺旋。氨基酸侧链伸向螺旋外侧。每3.6个氨基酸残基螺 旋上升一圈,螺距为0.54m。a-螺旋的每个肽键的N-H和第四个肽键的羰基氧形成氢健,氢键的方向 与螺旋长轴基本平行。肽链中的全部肽键都可形成氢键,以稳固α-螺旋结构。 20种氨基酸均可参与组成a-螺旋结构,但是Ala、Gu,Lcu和Mct比Gly、Po,Scr和Tyr更常见。在 3.6氢基酸残基 键的NH和第 。 图1-8c螺旋 12