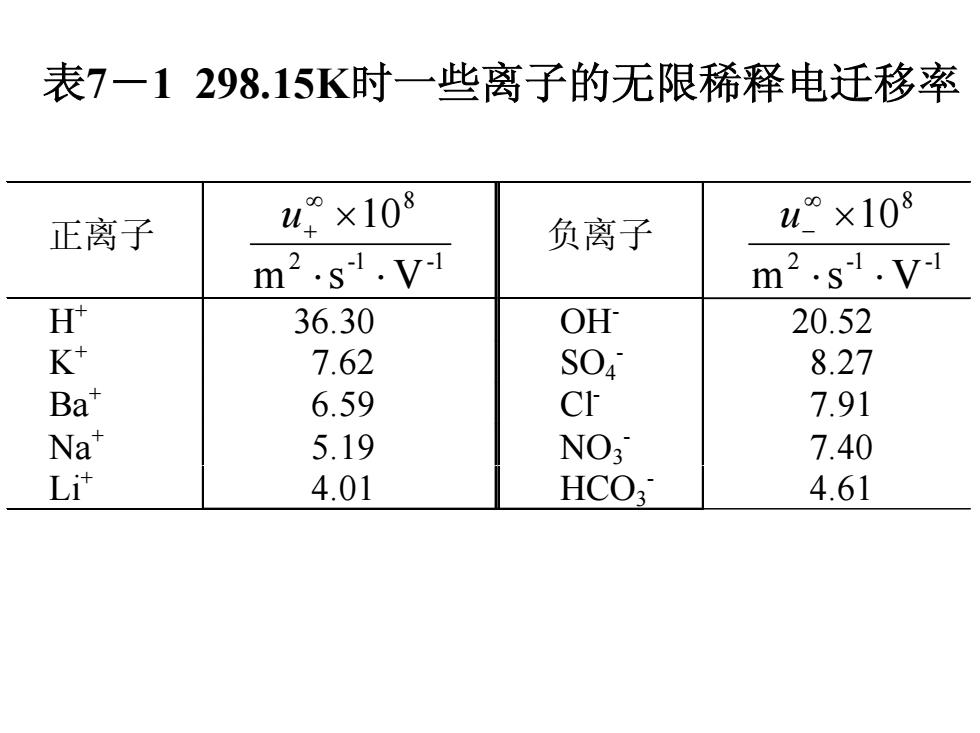
表7一1298.15K时一些离子的无限稀释电迁移率 正离子 u×108 负离子 u°×108 m2.s1.V-1 m2.s1.V-1 H 36.30 OH 20.52 K+ 7.62 SO4 8.27 Ba* 6.59 Cr 7.91 Na" 5.19 NO3 7.40 Li计 4.01 HCO 4.61
表7-1 298.15K时一些离子的无限稀释电迁移率 正离子 2 -1 -1 8 m s V 10 ⋅ ⋅ × ∞ u+ 负离子 2 -1 -1 8 m s V 10 ⋅ ⋅ × ∞ u − H+ 36.30 OH- 20.52 K+ 7.62 SO4- 8.27 Ba+ 6.59 Cl- 7.91 Na+ 5.19 NO3- 7.40 Li+ 4.01 HCO3- 4.61

7.2.3离子迁移数 把离子B所运载的电流与总电流之比称为离子B 的迁移数(transference number)用符号tB表示。 其定义式为: def /B t是量纲为1的量,数值上总小于1。 由于正、负离子移动的速率不同,所带的电荷不 等,因此它们在迁移电量时所分担的分数也不同
7.2.3 离子迁移数 把离子B所运载的电流与总电流之比称为离子B 的迁移数(transference number)用符号tB 表示。 B B def I t I 其定义式为: tB是量纲为1的量,数值上总小于1。 由于正、负离子移动的速率不同,所带的电荷不 等,因此它们在迁移电量时所分担的分数也不同

迁移数在数值上还可表示为: t, u: V++V_ u.+u 负离子应有类似的表示式。如果溶液中只有一种电 解质,则: t.+t =1 如果溶液中有多种电解质,共有i种离子,则: ∑4=∑1+∑1=1
迁移数在数值上还可表示为: + − + + − + + + + + = + = = = u u u v v v Q Q I I t t t + − + = 1 负离子应有类似的表示式。如果溶液中只有一种电 解质,则: ∑ ∑ t t i = + + = ∑ t − 1 如果溶液中有多种电解质,共有 i 种离子,则:

7.2.4迁移数的测定方法 l.Hittorf法 电钥 蓄电池 可变电阻 明 在Hittorfi迁移管中装入已知浓 电量计 度的电解质溶液,接通稳压直流 电流计 电源,这时电极上有反应发生, 正、负离子分别向阴、阳两极迁 夹 移。 阴 极 通电一段时间后,电极附近溶 极管 液浓度发生变化,中部基本不变。 中国管 小心放出阴极部(或阳极部) 溶液,称重并进行化学分析,根据 输入的电量和极区浓度的变化,就啼托夫法测定迁移数的装置 可计算离子的迁移数
7.2.4 迁移数的测定方法 1.Hittorf 法 在Hittorf迁移管中装入已知浓 度的电解质溶液,接通稳压直流 电源,这时电极上有反应发生, 正、负离子分别向阴、阳两极迁 移。 小心放出阴极部(或阳极部) 溶液,称重并进行化学分析,根据 输入的电量和极区浓度的变化,就 可计算离子的迁移数。 通电一段时间后,电极附近溶 液浓度发生变化,中部基本不变

Hittorf法中必须采集的数据: 1.通入的电量,由库仑计中称重阴极质量的增加而 得,例如,银库仑计中阴极上有0.0405gAg析出, n(电)=0.0405g/107.88 g.mol-=3.754×104mol 2.电解前含某离子的物质的量n(起始)。 3.电解后含某离子的物质的量n(终了)。 4.写出电极上发生的反应,判断某离子浓度是增加 了、减少了还是没有发生变化。 5.判断离子迁移的方向
Hittorf 法中必须采集的数据: 1. 通入的电量,由库仑计中称重阴极质量的增加而 得,例如,银库仑计中阴极上有0.0405 g Ag析出, 1 4 n( ) 0.0405 g /107.88 g mol 3.754 10 mol − − 电 = ⋅ = × 2. 电解前含某离子的物质的量n(起始)。 3.电解后含某离子的物质的量n(终了)。 4.写出电极上发生的反应,判断某离子浓度是增加 了、减少了还是没有发生变化。 5.判断离子迁移的方向