
电解池(electrolytic cell 电极①: ② 与外电源负极相接,是负极。 发生还原反应,是阴极。 Cu2+2e→Cu(S) 电极②: 与外电源正极相接,是正极。 CuSO4 发生氧化反应,是阳极。 Cu(S)→Cu2++2e
电解池(electrolytic cell) ① ② 电极①: 与外电源负极相接,是负极。 发生还原反应,是阴极。 Cu2++2e-→Cu(S) 电极②: 与外电源正极相接,是正极。 发生氧化反应,是阳极。 Cu(S)→ Cu2++2e-

7.1电解质溶液的导电机理及法拉第定律 7.1.1电解质溶液的导电机理 电解质溶液(electrolyte solution) 正离子(positive ion) 负离子(negative ion), 离子迁移方向: 阴离子迁向阳极 Anion -Anode 阳离子迁向阴极 Cation -Cathode
7.1 电解质溶液的导电机理及法拉第定律 7.1.1 电解质溶液的导电机理 电解质溶液 (electrolyte solution) 正离子(positive ion) 负离子(negative ion) 离子迁移方向: 阴离子迁向阳极 Anion → Anode 阳离子迁向阴极 Cation → Cathode

电 电子方向 电流方向 阳 极 极 电解池示款图 原电池示家图

7.1.2法拉第定律Faraday'sLw 通过电极的电量Q正比于电极反应的反应进度与 电极反应电荷数z的乘积。 电极反应: 氧化态+ze ·还原态 还原态 氧化态+ze Q-2F 法拉第常数F: F=Le=6.0221367×1023mo1×1.60217733×10-19C =96485.309Cmol-1 法拉第定律是电化学上最早的定量的基本定律, 揭示了通入的电量与析出物质之间的定量关系。 该定律在任何温度、任何压力下均可以使用。该 定律的使用没有什么限制条件
7.1.2 法拉第定律Faraday’s Law 通过电极的电量Q正比于电极反应的反应进度ξ与 电极反应电荷数z的乘积。 电极反应: 氧化态+ze- 还原态 还原态 氧化态+ze- Q=zFξ 法拉第常数F: F=Le=6.0221367×1023mol-1×1.60217733×10-19C =96485.309C·mol-1 法拉第定律是电化学上最早的定量的基本定律, 揭示了通入的电量与析出物质之间的定量关系。 该定律在任何温度、任何压力下均可以使用。该 定律的使用没有什么限制条件
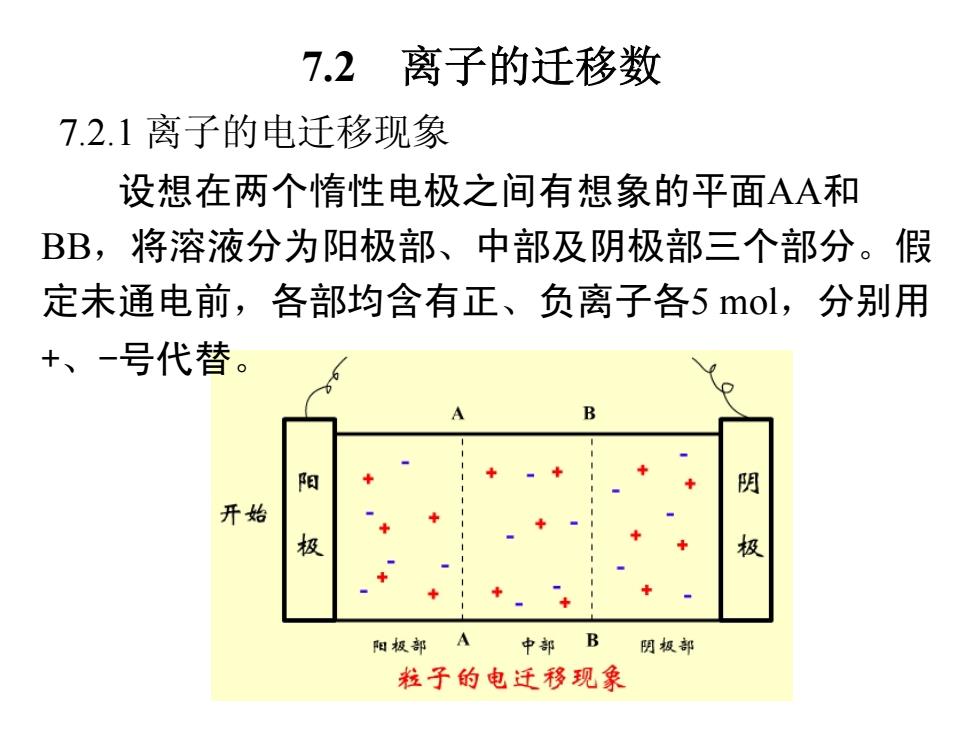
7.2离子的迁移数 7.2.1离子的电迁移现象 设想在两个惰性电极之间有想象的平面AA和 BB,将溶液分为阳极部、中部及阴极部三个部分。假 定未通电前,各部均含有正、负离子各5mol,分别用 +、-号代替。 B 阳 阴 开始 极 极 阳极部 A 中部B 阴极部 粒子的电迁移现象
7.2 离子的迁移数 7.2.1 离子的电迁移现象 设想在两个惰性电极之间有想象的平面AA和 BB,将溶液分为阳极部、中部及阴极部三个部分。假 定未通电前,各部均含有正、负离子各5 mol,分别用 +、-号代替