
2、内能函数U 内能(internal energy)是系统内部各种运 动形态的能量的总和,包括分子的平动能 e,振动能ev,转动能e以及电子的能量e, 原子核的能量ε以及分子间相互作用的位 能。内能的绝对值是无法确定的。 内能是一种广度性质的状态函数,其单位为 焦耳(J)。 内能函数的改变值△U只决定于系统的始末 态,而与途径无关
• 2、内能函数U • 内能(internal energy)是系统内部各种运 动形态的能量的总和,包括分子的平动能 εt,振动能εv,转动能εr以及电子的能量εe, 原子核的能量εn以及分子间相互作用的位 能。内能的绝对值是无法确定的。 • 内能是一种广度性质的状态函数,其单位为 焦耳(J)。 • 内能函数的改变值ΔU只决定于系统的始末 态,而与途径无关

3、热力学第一定律的数学表达式 对于一个封闭系统,当系统从一个状态变化 到另一个状态时,系统与环境之间功交换为 W,热的交换为Q,根据热力学第一定律内 能的改变△U: △U=Q+W dU=60+6W 上式就是封闭系统热力学第一定律的数学表 达式
• 3、热力学第一定律的数学表达式 • 对于一个封闭系统,当系统从一个状态变化 到另一个状态时,系统与环境之间功交换为 W,热的交换为Q,根据热力学第一定律内 能的改变ΔU: • ΔU = Q + W • dU =δQ + δW • 上式就是封闭系统热力学第一定律的数学表 达式

3、焓 按照状态函数的性质,状态函数的组合仍然是 一个状态函数。由于U、p、V都是状态函数, 所以其组合也是一个状态函数。为此定义一个 新的状态函数,称为焓(enthalpy),用符号 “H”表示,即 H=U+pV 焓是广度性质的状态函数,其单位为焦耳 (J) o (1)由于内能的绝对值无法确定,因此焓的绝对值也 无法确定。 (2)由于U、p、V都是状态函数,焓也是一个状态函 数,其改变值△H只与过程的始末态有关,而与 途径无关
3、焓 按照状态函数的性质,状态函数的组合仍然是 一个状态函数。由于 U 、 p 、 V都是状态函数, 所以其组合也是一个状态函数。为此定义一个 新的状态函数,称为焓(enthalpy ),用符号 “ H ”表示,即 H = U + pV 焓是广度性质的状态函数,其单位为焦耳 ( J) 。 (1)由于内能的绝对值无法确定,因此焓的绝对值也 无法确定。 (2)由于 U 、 p 、 V都是状态函数,焓也是一个状态函 数,其改变值Δ H只与过程的始末态有关,而与 途径无关
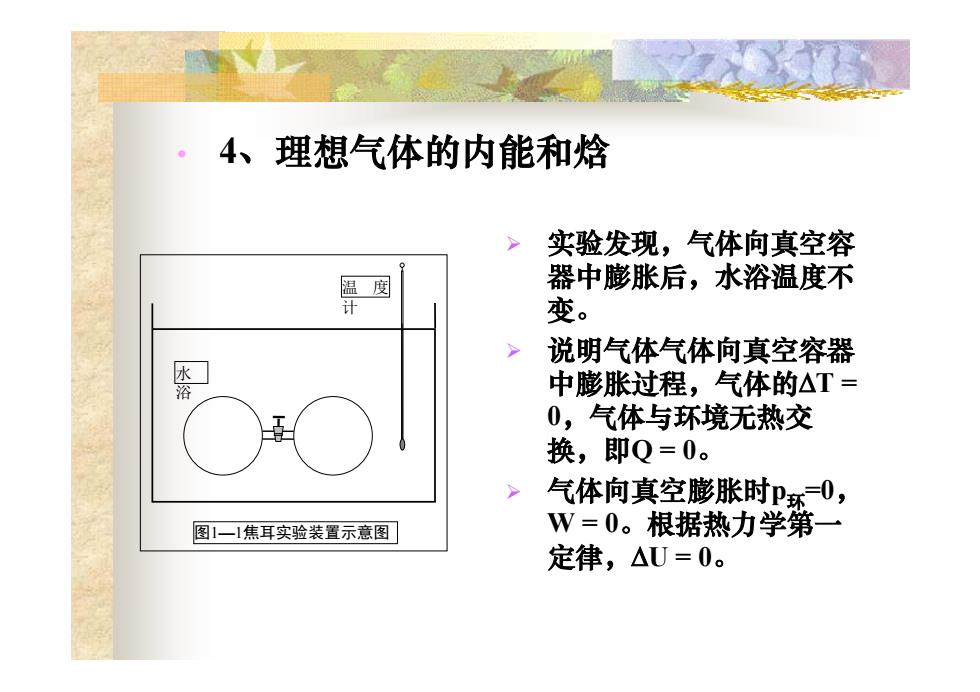
4、理想气体的内能和焓 实验发现,气体向真空容 温度 器中膨胀后,水浴温度不 计 变。 说明气体气体向真空容器 水 浴 中膨胀过程,气体的△T= 0,气体与环境无热交 换,即Q=0。 气体向真空膨胀时P环0, 图1一1焦耳实验装置示意图 W=0。根据热力学第一 定律,△U=0
• 4、理想气体的内能和焓 水 浴 温 度 计 图1—1焦耳实验装置示意图 ¾ 实验发现,气体向真空容 器中膨胀后,水浴温度不 变。 ¾ 说明气体气体向真空容器 中膨胀过程,气体的ΔT = 0,气体与环境无热交 换,即Q = 0。 ¾ 气体向真空膨胀时p环=0, W = 0。根据热力学第一 定律,ΔU = 0

内能可表示为: U=f(T,V) >对于系统的微小变化,则有 >在焦耳实验中,dT=0,dU=0,而dV≠0,所以必有 ,=0 aU 同理,由U=f(T,p)可得: >即 U=f(T)
¾ 内能可表示为: ¾ U = f ( T, V ) ¾ 对于系统的微小变化,则有 ¾ 在焦耳实验中,dT = 0, dU = 0, 而dV ≠ 0, 所以必有 ¾ ¾ 同理,由U = f ( T, p )可得: ¾ 即 U = f ( T ) d ( )d ( )d V T U U U TV T V ∂ ∂ = + ∂ ∂ ()0 T UV∂ = ∂ ()0 T U p ∂ = ∂