定义 反应速率(Reaction rate)是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dmr3,时间常用s,min,h,d,y.反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法 7.1.12平均速度与瞬时速度 ●平均速率 平均速率(average rate)是指反应进程中某时间间隔(△t)内参与反应 的物质的量的变化量.常用单位时间内反应物浓度的减少或者产物浓度的 增加来表示 一般式表示为: r≡△na/△ (7-1) 式中:△n。一一时间间隔△(但1终态-1始态)内 参与反应的物质B的物质的 量的变化数(△ng≡n终-n始)。 6 上页下页 节首 节尾
6 反应速率 (Reaction rate) 是指给定条件下反应物通过化学反应转化为 产物的速率,常用单位时间内反应物浓度的减少或者产物浓度的增加来表示. 浓度常用mol.dm-3,时间常用s,min,h,d,y. 反应速率又分为平均速率 (average rate)和瞬时速率(instaneous rate)两种表示方法. 定义 ●平均速率 7.1.12 平均速度与瞬时速度 平均速率 (average rate) 是指反应进程中某时间间隔(Δt)内参与反应 的物质的量的变化量.常用单位时间内反应物浓度的减少或者产物浓度的 增加来表示. 一般式表示为: 量的变化数 。 参与反应的物质 的物质的 式中: — —时间间隔 内 终 始 终态 始态 ( ) ( ) / n n n B n t t t r n t B B B (7 -1)

对于在体积一定的密闭容器内进行的化学反应,常用单位时间内反应物浓 度的减少或者产物浓度的增加来表示。 一般式表示为: r=△cB/△1 (7-2) 式中:△Cg一一时间间隔△(信1终态一t始态)内 参与反应的物质B的物质的 量的变化数(△cg≡c终-C始) 取绝对值的原因:反应速率不管大小,总是正值, 用浓度的变化量表示平均反应速度,表达式可能不一样.如:3H2+N22NH3 r=-△C(H,)/△ 取一般通式: r'=-△c(N2)/△M r≡(1/ya)△cB/△1(7-3) r"=△cNH)/Ar V。是物质B在配平的化学方程式中的化学计量数。 化学计量数的数符规定一反应物负值,生成物正值。 上顶 下页 节首节尾
7 对于在体积一定的密闭容器内进行的化学反应,常用单位时间内反应物浓 度的减少或者产物浓度的增加来表示. 一般式表示为: 量的变化数 。 参与反应的物质 的物质的 式中: — —时间间隔 内 终 始 终态 始态 ( ) ( ) / c c c B c t t t r c t B B B (7 - 2) 取绝对值的原因:反应速率不管大小,总是正值. 用浓度的变化量表示平均反应速度,表达式可能不一样.如: 3H2+N2=2NH3 r c NH t r c N t r c H t ( )/ ( )/ ( )/ '' ' 3 2 2 取一般通式: 化学计量数的数符规定 反应物负值,生成物正值。 是物质 在配平的化学方程式中的化学计量数。 B r c t B B B (1/ ) / (7 - 3)

瞬时速率 Example 2 2N20=4N02+02,用反应物和产物表示都可以 Rate of consumption Rate of production (Rate of production of N2Os of NO2 of02) 1△cN2Os) 1△cNO) 一一X 一X △c(O2) 21 △M 4 △t △ 对于一般的化学反应: r≡(I/va)dca/d0 aA +bB yY 3Z dcB dcy dcz YE- adt bdt ydt zdt ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化 ▲速率方程相同,但各自的不同。 上页下页 节首 节尾
8 Rate of consumption of N2O5 Rate of production of NO2 (Rate of production of O2 = = ) t c ( 5) N2O 2 1 t c (NO) 4 1 t c O ( ) 2 = = z t c y t c b t c a t c r d d d d d d d d A B Y Z aA + bB yY + zZ ▲实际工作中如何选择,往往取决于哪一种物质更易通过试验 监测其浓度变化. ▲速率方程相同,但各自的k不同. 对于一般的化学反应: 2N2O5=4NO2+O2 , 用反应物和产物表示都可以 Example 2 r dc dt B B (1/ ) / ● 瞬时速率

u® 反应2W+X一Y+Z哪种速率表达式是正确的? dc(X) dc(Y) a dt dt b. dc(X) dc(W dt dt de(Z) C. de(Y) dt dt d. dc(Z) de(W) dt dt 9 止页下页 节首节尾
9 Question 1 反应 2W+X Y+Z 哪种速率表达式是正确的? t c W t c Z t c Y t c Z t c W t c X t c Y t c X d d d d d d d d d d d d d d d d d c b. a. ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) . .
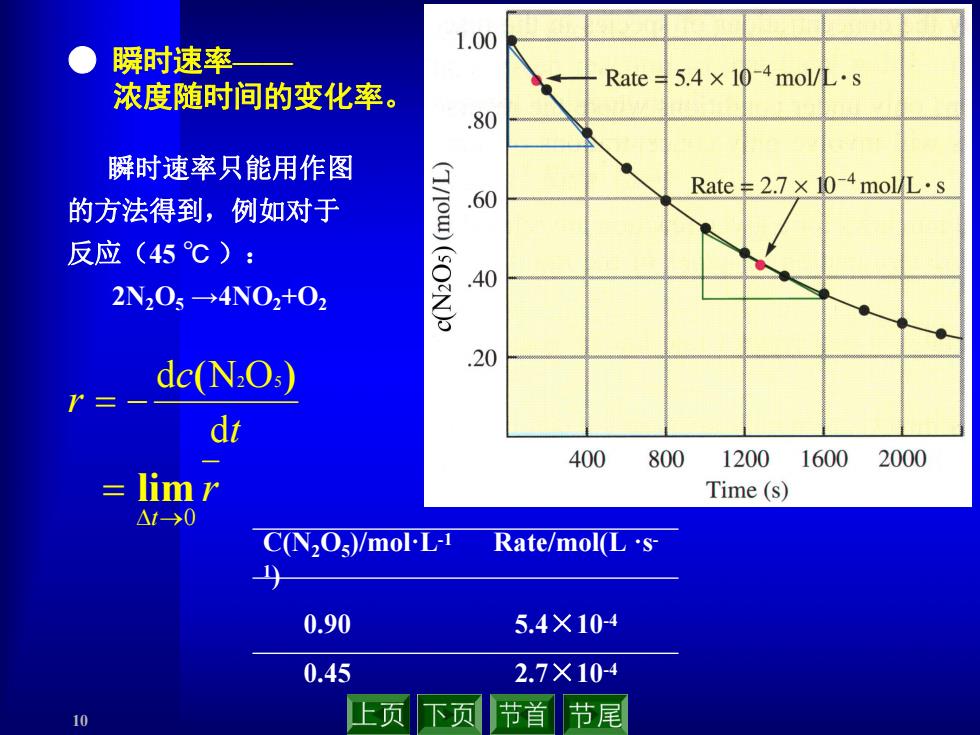
1.00 瞬时速率 Rate5.4×10-4mol/L·s 浓度随时间的变化率。 .80 瞬时速率只能用作图 11110m Rate¥2.7×10-4mol/L·s 的方法得到,例如对于 .60 反应(45℃): .40 2N205→4N02t02 dc(N2O,) .20 r= dt 400 800 12001600 2000 三 limr Time(s) △1-→0 C(N2Os)/mol-L-1 Rate/mol(Ls 0.90 5.4×104 0.45 2.7×104 10 止页 下页 节首节尾
10 r t0 lim ● 瞬时速率—— 浓度随时间的变化率。 t c r d d (N2O5) C(N2O5)/mol·L-1 Rate/mol(L ·s - 1) 0.90 5.4×10-4 0.45 2.7×10-4 瞬时速率只能用作图 的方法得到,例如对于 反应(45 ℃ ): 2N2O5 →4NO2+O2