
离域键的形成需要三个条件: (1)参加成键的原子数大于(或等于)3,而且这 些原子必须在同一个平面上,否则就不能相互重叠 (2)每个参加成键的原子都有一个相互平行的P 轨道,如果中间某一原子没有平行的P轨道就不能 连成大π键; (3)P电子的数目必须小于P轨道(成键原子)数 目的两倍。(因为如果P电子数目等于P轨道数目的 两倍的话,根据分子轨道理论,则成键轨道与反键 轨道都被填满,净成键电子数等于零,不能形成大π 键。)
(1)参加成键的原子数大于(或等于)3,而且这 些原子必须在同一个平面上,否则就不能相互重叠; (2)每个参加成键的原子都有一个相互平行的P 轨道,如果中间某一原子没有平行的P轨道就不能 连成大π键; (3)P电子的数目必须小于P轨道(成键原子)数 目的两倍。(因为如果P电子数目等于P轨道数目的 两倍的话,根据分子轨道理论,则成键轨道与反键 轨道都被填满,净成键电子数等于零,不能形成大π 键。) 离域π键的形成需要三个条件:
四、配位共价键 (coordinate covalent bond) 如果共价键的形成是由成键两原子中的一个原子单 独提供电子对进入另一个原子的空轨道共用而成键 这种共价键称为配位共价键,简称配位键。 配位键用”一→”表示,箭头从提供电子对的原子指 向接受电子对的原子。 H Co
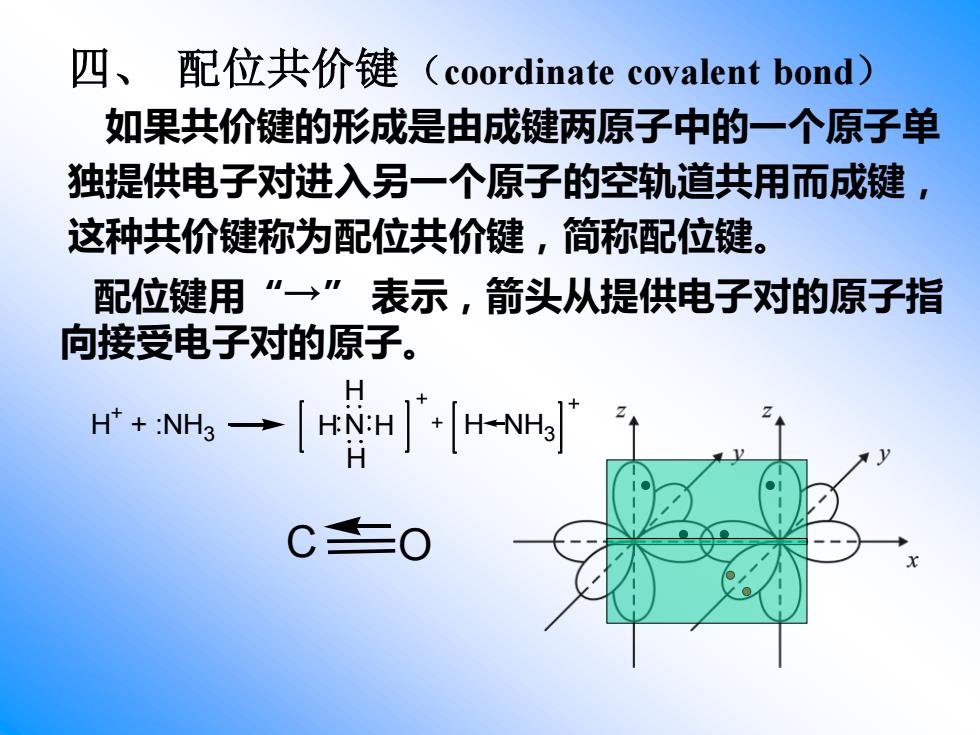
四、 配位共价键(coordinate covalent bond) 如果共价键的形成是由成键两原子中的一个原子单 独提供电子对进入另一个原子的空轨道共用而成键, 这种共价键称为配位共价键,简称配位键。 H + + :NH3 H N H H H + + H NH3 + 配位键用“→” 表示,箭头从提供电子对的原子指 向接受电子对的原子。 C O

五、键参数 表征化学键性质的物理量称为键参数。 主要有键能、键长、键角及键的极性。 l.键能(bond energy) 双原子分子的键能(月就等于分子的解离能(D)。 将1摩尔理想气态分子AB解离为理想气态的A、B 原子所需要的能量,称为AB的解离能。 H2(g列→2H(g EH-H)=D(H-H)=436 kJ.mol-1 同一种共价键在不同的多原子分子中的键能 虽有差别,但差别不大。不同分子中同一种键能 的平均值即平均键能作为该键的键能
1. 键能(bond energy) 双原子分子的键能(E)就等于分子的解离能(D)。 将1摩尔理想气态分子AB解离为理想气态的A、B 原子所需要的能量,称为AB的解离能。 H2 (g) → 2H(g) E(H—H) = D(H—H) = 436 kJ·mol-1 五、键参数 表征化学键性质的物理量称为键参数。 主要有键能、键长、键角及键的极性。 同一种共价键在不同的多原子分子中的键能 虽有差别,但差别不大。不同分子中同一种键能 的平均值即平均键能作为该键的键能