
本报告期内国家局共批准药品补充申请2618件,其中中药天然药 物310件,化学药品1909件,生物制品399件;共批准备案申请156 件,其中中药天然药物4件,化学药品119件,生物制品33件。详见 附表12。 11.省局受理/接收事项审批情况 本报告期内全国各省(区、市)局共批准通过药品上市后变更备案 10616件,其中中药天然药物4847件,化学药品5554件,生物制品215 件。详见附表13。 12.按药品管理的体外诊断试剂上市申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂上市申请0 件。详见附表14。 13.按药品管理的体外诊断试剂再注册及补充申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂再注册申请 0件,补充申请3件。详见附表15。 14.批准创新药上市情况 本报告期内国家局共批准创新药上市品种21个,其中中药天然药 物0个,化学药品16个,生物制品5个。详见附表16。 15.批准创新药临床试验情况 本报告期内国家局共批准创新药临床品种649个,其中药天然药物 13个,化学药品455个,生物制品181个。详见附表17. (三)国产、进口药品批准文号情况 截至2021年6月底,共有国产药品批准文号149749件,其中中药 天然药物56681件,化学药品91334件,生物制品1667件,辅料67 件;共有境外生产药品注册证3874件,其中中药天然药物86件,化学 药品2767件,生物制品481件,辅料76件,境外生产药品分包装464
3 本报告期内国家局共批准药品补充申请 2618 件,其中中药天然药 物 310 件,化学药品 1909 件,生物制品 399 件;共批准备案申请 156 件,其中中药天然药物 4 件,化学药品 119 件,生物制品 33 件。详见 附表 12。 11.省局受理/接收事项审批情况 本报告期内全国各省(区、市)局共批准通过药品上市后变更备案 10616 件,其中中药天然药物 4847 件,化学药品 5554 件,生物制品 215 件。详见附表 13。 12.按药品管理的体外诊断试剂上市申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂上市申请 0 件。详见附表 14。 13.按药品管理的体外诊断试剂再注册及补充申请的审批情况 本报告期内国家局共批准按药品管理的体外诊断试剂再注册申请 0 件,补充申请 3 件。详见附表 15。 14.批准创新药上市情况 本报告期内国家局共批准创新药上市品种 21 个,其中中药天然药 物 0 个,化学药品 16 个,生物制品 5 个。详见附表 16。 15.批准创新药临床试验情况 本报告期内国家局共批准创新药临床品种 649 个,其中药天然药物 13 个,化学药品 455 个,生物制品 181 个。详见附表 17。 (三)国产、进口药品批准文号情况 截至 2021 年 6 月底,共有国产药品批准文号 149749 件,其中中药 天然药物 56681 件,化学药品 91334 件,生物制品 1667 件,辅料 67 件;共有境外生产药品注册证 3874 件,其中中药天然药物 86 件,化学 药品 2767 件,生物制品 481 件,辅料 76 件,境外生产药品分包装 464
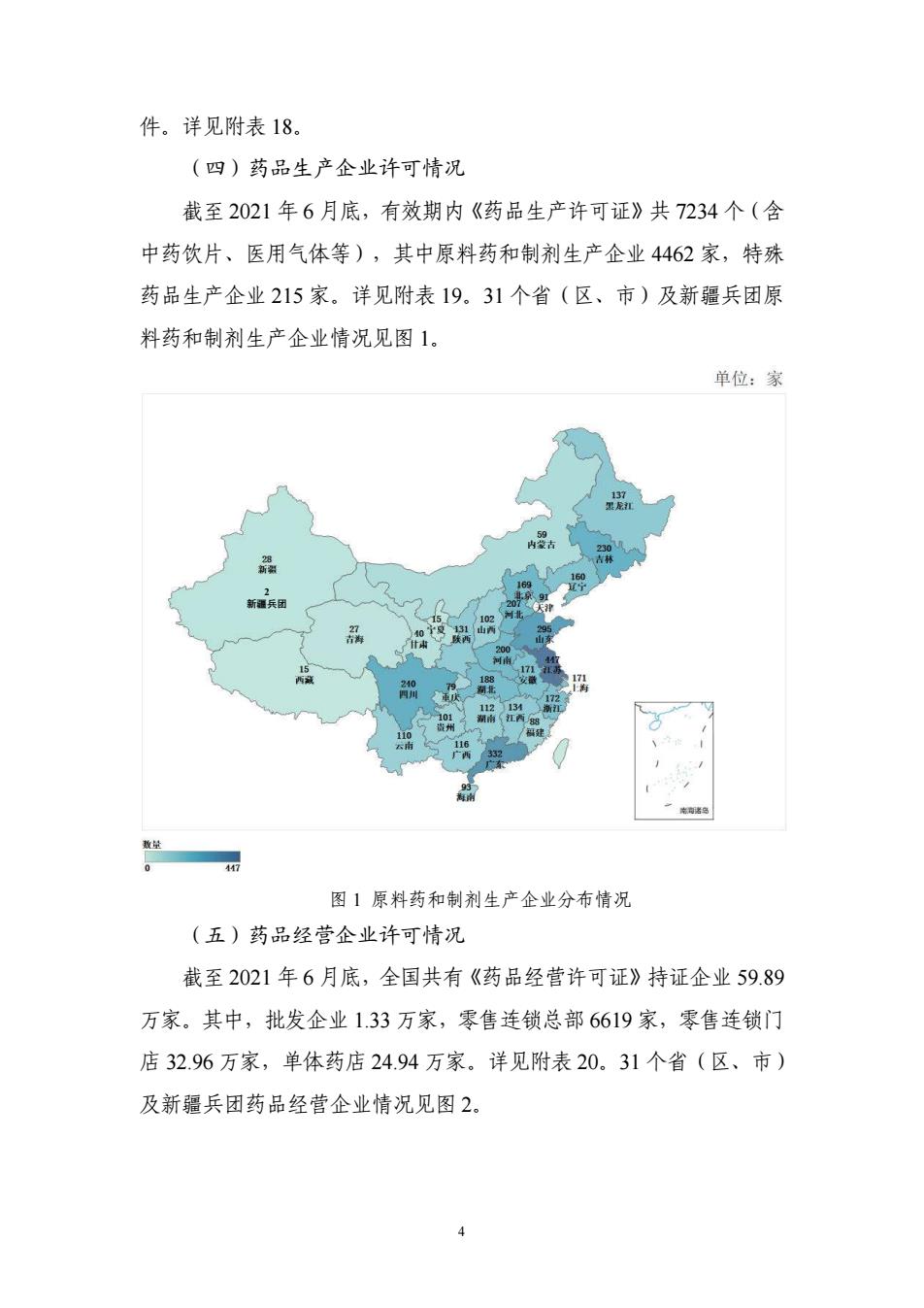
件。详见附表18。 (四)药品生产企业许可情况 截至2021年6月底,有效期内《药品生产许可证》共7234个(含 中药饮片、医用气体等),其中原料药和制剂生产企业4462家,特殊 药品生产企业215家。详见附表19.31个省(区、市)及新疆兵团原 料药和制剂生产企业情况见图1。 单位:家 内击 新疆兵团 0 172 数 图1原料药和制剂生产企业分布情况 (五)药品经营企业许可情况 截至2021年6月底,全国共有《药品经营许可证》持证企业59.89 万家。其中,批发企业1.33万家,零售连锁总部6619家,零售连锁门 店32.96万家,单体药店24.94万家。详见附表20.31个省(区、市) 及新疆兵团药品经营企业情况见图2
4 件。详见附表 18。 (四)药品生产企业许可情况 截至 2021 年 6 月底,有效期内《药品生产许可证》共 7234 个(含 中药饮片、医用气体等),其中原料药和制剂生产企业 4462 家,特殊 药品生产企业 215 家。详见附表 19。31 个省(区、市)及新疆兵团原 料药和制剂生产企业情况见图 1。 图 1 原料药和制剂生产企业分布情况 (五)药品经营企业许可情况 截至 2021 年 6 月底,全国共有《药品经营许可证》持证企业 59.89 万家。其中,批发企业 1.33 万家,零售连锁总部 6619 家,零售连锁门 店 32.96 万家,单体药店 24.94 万家。详见附表 20。31 个省(区、市) 及新疆兵团药品经营企业情况见图 2。 2 新疆兵团
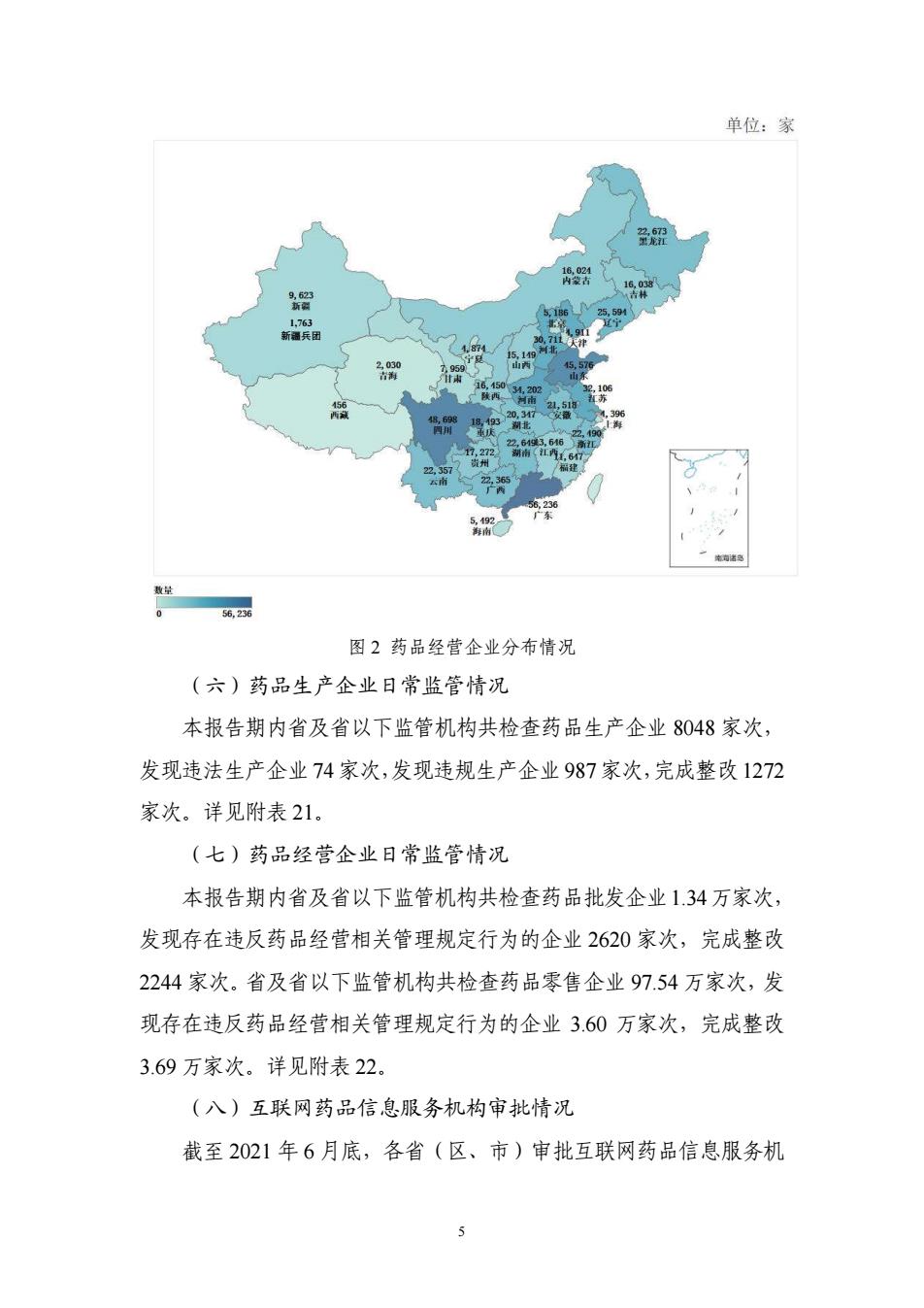
单位:家 9,623 新钢 1.763 新兵团 云南 5,23 数量 56,236 图2药品经营企业分布情况 (六)药品生产企业日常监管情况 本报告期内省及省以下监管机构共检查药品生产企业8048家次, 发现违法生产企业74家次,发现违规生产企业987家次,完成整改1272 家次。详见附表21。 (七)药品经营企业日常监管情况 本报告期内省及省以下监管机构共检查药品批发企业1.34万家次, 发现存在违反药品经营相关管理规定行为的企业2620家次,完成整改 2244家次。省及省以下监管机构共检查药品零售企业97.54万家次,发 现存在违反药品经营相关管理规定行为的企业3.60万家次,完成整改 3.69万家次。详见附表22。 (八)互联网药品信息服务机构审批情况 截至2021年6月底,各省(区、市)审批互联网药品信息服务机
5 图 2 药品经营企业分布情况 (六)药品生产企业日常监管情况 本报告期内省及省以下监管机构共检查药品生产企业 8048 家次, 发现违法生产企业74 家次,发现违规生产企业987 家次,完成整改1272 家次。详见附表 21。 (七)药品经营企业日常监管情况 本报告期内省及省以下监管机构共检查药品批发企业1.34万家次, 发现存在违反药品经营相关管理规定行为的企业 2620 家次,完成整改 2244 家次。省及省以下监管机构共检查药品零售企业 97.54 万家次,发 现存在违反药品经营相关管理规定行为的企业 3.60 万家次,完成整改 3.69 万家次。详见附表 22。 (八)互联网药品信息服务机构审批情况 截至 2021 年 6 月底,各省(区、市)审批互联网药品信息服务机 1,763 新疆兵团

构19924家。详见附表23。 (九)地方药品抽检情况 本报告期内各省(区、市)共检验药品67215批次,不合格212 批次,不合格率0.32%。详见附表24。 (十)进口药品检验情况 本报告期内中检院及17个口岸药检所对涉及48个国家或地区的 4260批次、75.09亿美元的申请进口药品进行了检验,检验药品批次数 同比增加23.98%(去年同期3436批次),金额数同比增加51.27%(去 年同期49.64亿美元)。检验不合格57批次,占总批次的1.34%,不 合格药品金额达802.07万美元。进口药品检验情况详见附表25~27。 (十一)药品案件查处情况 本报告期内全国共查处药品违法案件20167件,案件货值金额共计 19412.01万元。罚款金额共40069.27万元,没收违法所得8160.91万元, 捣毁制假售假窝点24个,责令停产停业145家(包括生产企业13家和 经营企业132家),吊销许可证13件(包括生产许可证1件和经营许 可证12件),移送司法机关157件。 查处药品案件数量排在前5位的省份依次为山东、四川、河北、辽 宁、广东。从货值划分来看,货值10万元以下的案件有20035件,占 药品案件总数的99.35%;货值10万元至20万元的案件有59件,占比 0.29%;货值20万元至50万元的案件有28件,占比0.14%;货值50 万元至1000万元的案件有43件,占比0.21%;货值1000万元至1亿 元的案件有2件,分别由湖南、福建查处;2021年1月至6月未查处1 亿元以上的药品类案件。 从违法主体来看,药品生产企业案件有403件,占全部药品案件数 的2.00%;经营企业案件有14253件,占比70.67%;医疗机构案件有 6
6 构 19924 家。详见附表 23。 (九)地方药品抽检情况 本报告期内各省(区、市)共检验药品 67215 批次,不合格 212 批次,不合格率 0.32%。详见附表 24。 (十)进口药品检验情况 本报告期内中检院及 17 个口岸药检所对涉及 48 个国家或地区的 4260 批次、75.09 亿美元的申请进口药品进行了检验,检验药品批次数 同比增加 23.98%(去年同期 3436 批次),金额数同比增加 51.27%(去 年同期 49.64 亿美元)。检验不合格 57 批次,占总批次的 1.34%,不 合格药品金额达 802.07 万美元。进口药品检验情况详见附表 25~27。 (十一)药品案件查处情况 本报告期内全国共查处药品违法案件 20167 件,案件货值金额共计 19412.01 万元。罚款金额共 40069.27 万元,没收违法所得 8160.91 万元, 捣毁制假售假窝点 24 个,责令停产停业 145 家(包括生产企业 13 家和 经营企业 132 家),吊销许可证 13 件(包括生产许可证 1 件和经营许 可证 12 件),移送司法机关 157 件。 查处药品案件数量排在前 5 位的省份依次为山东、四川、河北、辽 宁、广东。从货值划分来看,货值 10 万元以下的案件有 20035 件,占 药品案件总数的 99.35%;货值 10 万元至 20 万元的案件有 59 件,占比 0.29%;货值 20 万元至 50 万元的案件有 28 件,占比 0.14%;货值 50 万元至 1000 万元的案件有 43 件,占比 0.21%;货值 1000 万元至 1 亿 元的案件有 2 件,分别由湖南、福建查处;2021 年 1 月至 6 月未查处 1 亿元以上的药品类案件。 从违法主体来看,药品生产企业案件有 403 件,占全部药品案件数 的 2.00%;经营企业案件有 14253 件,占比 70.67%;医疗机构案件有

4782件,占比23.71%;其他主体案件有729件,占比3.61%。 生产销售假劣药品方面,共查处生产销售和使用假劣药案件3958 件(其中通过互联网销售假劣药案件19件),货值金额3887.21万元, 罚款13095.52万元,移送司法机关100件。详见附表28。 二、医疗器械监督管理 (一)医疗器械行政受理情况 本报告期内,全国共完成第一类医疗器械备案14921件,其中,境 内第一类医疗器械备案14590件,进口第一类医疗器械备案331件。全 国共受理首次注册申请8269件,其中,境内第二类首次注册医疗器械 7142件,境内第三类首次注册医疗器械782件,进口首次注册医疗器 械(含港澳台)345件。全国共受理延续注册申请8158件,其中,境 内第二类医疗器械延续注册申请5242件,境内第三类医疗器械延续注 册申请1063件,进口医疗器械(含港澳台)延续注册申请1853件。详 见附表29。 (二)医疗器械产品注册情况 本报告期内,全国共批准各类医疗器械首次注册7117件,延续注 册8657件。其中,批准境内第二类医疗器械首次注册6381件,境内第 三类医疗器械首次注册494件,进口医疗器械(含港澳台)首次注册 242件;批准境内第二类医疗器械延续注册5486件,境内第三类医疗 器械延续注册1168件,进口医疗器械(含港澳台)延续注册2003件。 截至2021年6月底,全国累计共有境内第一类医疗器械备案 107904件;各省级局共批准境内第二类医疗器械注册72680件。详见 附表29。 (三)医疗器械生产企业基本情况 截至2021年6月底,全国实有医疗器械生产企业2.75万家,其中: >
7 4782 件,占比 23.71%;其他主体案件有 729 件,占比 3.61%。 生产销售假劣药品方面,共查处生产销售和使用假劣药案件 3958 件(其中通过互联网销售假劣药案件 19 件),货值金额 3887.21 万元, 罚款 13095.52 万元,移送司法机关 100 件。详见附表 28。 二、医疗器械监督管理 (一)医疗器械行政受理情况 本报告期内,全国共完成第一类医疗器械备案 14921 件,其中,境 内第一类医疗器械备案 14590 件,进口第一类医疗器械备案 331 件。全 国共受理首次注册申请 8269 件,其中,境内第二类首次注册医疗器械 7142 件,境内第三类首次注册医疗器械 782 件,进口首次注册医疗器 械(含港澳台)345 件。全国共受理延续注册申请 8158 件,其中,境 内第二类医疗器械延续注册申请 5242 件,境内第三类医疗器械延续注 册申请 1063 件,进口医疗器械(含港澳台)延续注册申请 1853 件。详 见附表 29。 (二)医疗器械产品注册情况 本报告期内,全国共批准各类医疗器械首次注册 7117 件,延续注 册 8657 件。其中,批准境内第二类医疗器械首次注册 6381 件,境内第 三类医疗器械首次注册 494 件,进口医疗器械(含港澳台)首次注册 242 件;批准境内第二类医疗器械延续注册 5486 件,境内第三类医疗 器械延续注册 1168 件,进口医疗器械(含港澳台)延续注册 2003 件。 截至 2021 年 6 月底,全国累计共有境内第一类医疗器械备案 107904 件;各省级局共批准境内第二类医疗器械注册 72680 件。详见 附表 29。 (三)医疗器械生产企业基本情况 截至 2021 年 6 月底,全国实有医疗器械生产企业 2.75 万家,其中: