
11.1单质 066000006605000000英0000006000660060000000000戏0收 ·C2BI2、2、S、P与碱的反应 常温下 CI2+20H=CI+CIO-+H,O 3Br2+60H=3Br+BrO,+3H,O 3L2+6OH=3+I03+3H20 加热条件下 歧化反应 CL2+60H=C+C103+3H2O 3S+60H=2S2+S032+3H0 4P+3OH-+3H2O=3H2PO2+PH3 冈
常温下 Cl2+2OH-=Cl-+ClO-+H2O 3Br2+6OH-=3Br-+BrO3 -+3H2O 3I2+6OH-=3I-+IO3 -+3H2O 加热条件下 Cl2+6OH-=Cl-+ClO3 -+3H2O 3S+6OH-=2S2-+SO3 2-+3H2O 4P+3OH-+3H2O=3H2PO2 -+PH3 歧化反应 • Cl2、Br2、I2、S、P与碱的反应 11.1 单质

11.2氢化物 11.2.1离子型氢化物及性质 ○11.2.2共价型氢化物
11.2 氢化物 11.2.1 离子型氢化物及性质 11.2.2 共价型氢化物
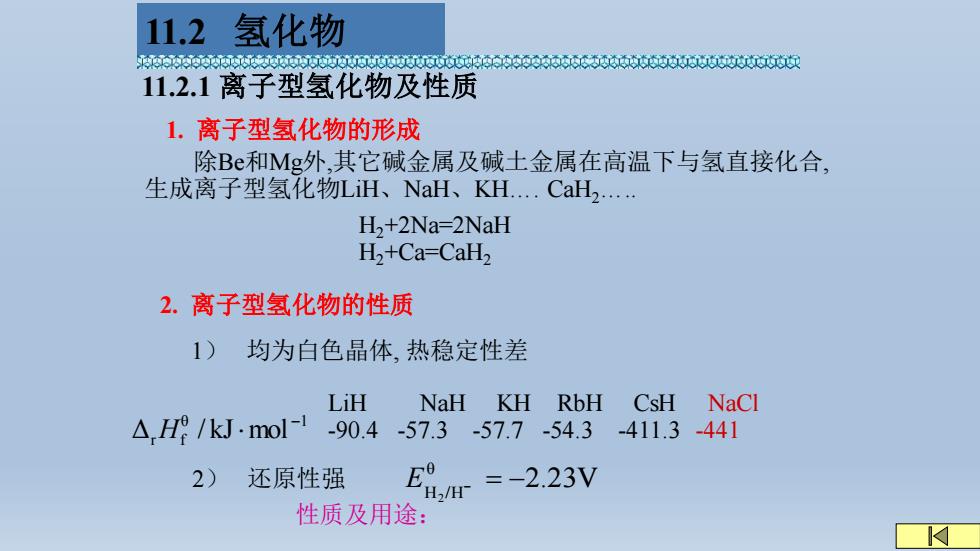
11.2氢化物 65660600066606066660060600 11.2.1离子型氢化物及性质 1.离子型氢化物的形成 除B和Mg外,其它碱金属及碱土金属在高温下与氢直接化合, 生成离子型氢化物LiH、NaH、KH..CaH2. H,+2Na=2NaH H2+Ca-CaH2 2.离子型氢化物的性质 1)均为白色晶体,热稳定性差 LiH NaH KH RbH CsH NaCl △.H/kJ.mol-190.4-57.3 -57.7-54.3 -411.3-441 2) 还原性强 E9 / =-2.23V 性质及用途: ☑
11.2.1 离子型氢化物及性质 1. 离子型氢化物的形成 除Be和Mg外,其它碱金属及碱土金属在高温下与氢直接化合, 生成离子型氢化物LiH、NaH、KH…. CaH2….. H2+2Na=2NaH H2+Ca=CaH2 2. 离子型氢化物的性质 LiH NaH KH RbH CsH NaCl -90.4 -57.3 -57.7 -54.3 -411.3 -441 θ 1 Δr f / kJ mol − H 1) 均为白色晶体, 热稳定性差 2) 还原性强 2.23V θ H2 /H E − = − 性质及用途: 11.2 氢化物
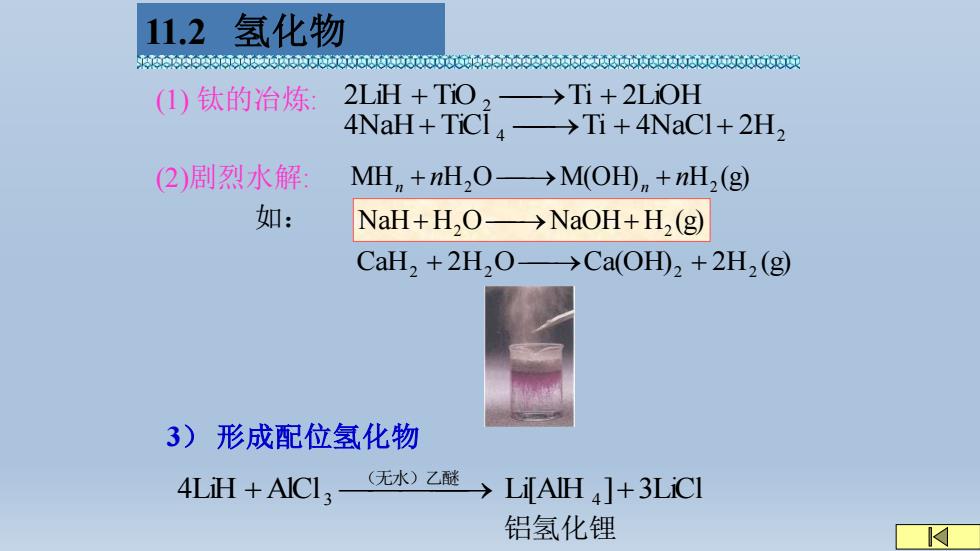
11.2 氢化物 0600年00006660066060t5660英英00 (1)钛的治炼: +TR,之+40+2H 2)剧烈水解 MH,+nH,O->M(OH)+nH,(g) 如: NaH+H,O→NaOH+H2(g) CaH,+2H,O->Ca(OH),+2H2(g) 3)形成配位氢化物 4LiH +AICI3- (无水)乙醚→ LiAIH ]+3LiCI 铝氢化锂 M
4NaH + TiCl 4 ⎯→Ti + 4NaCl+ 2H2 (2)剧烈水解: MH H O M(OH) H (g) 2 2 n n n + ⎯→ n + (1) 钛的冶炼: 2LiH + TiO 2 ⎯→Ti + 2LiOH CaH 2H O Ca(OH) 2H (g) 2 + 2 ⎯→ 2 + 2 如: 3) 形成配位氢化物 4LiH AlCl Li[AlH ] 3LiCl + 3 ⎯⎯⎯⎯→ 4 + (无水)乙醚 铝氢化锂 NaH H O NaOH H (g) + 2 ⎯→ + 2 11.2 氢化物
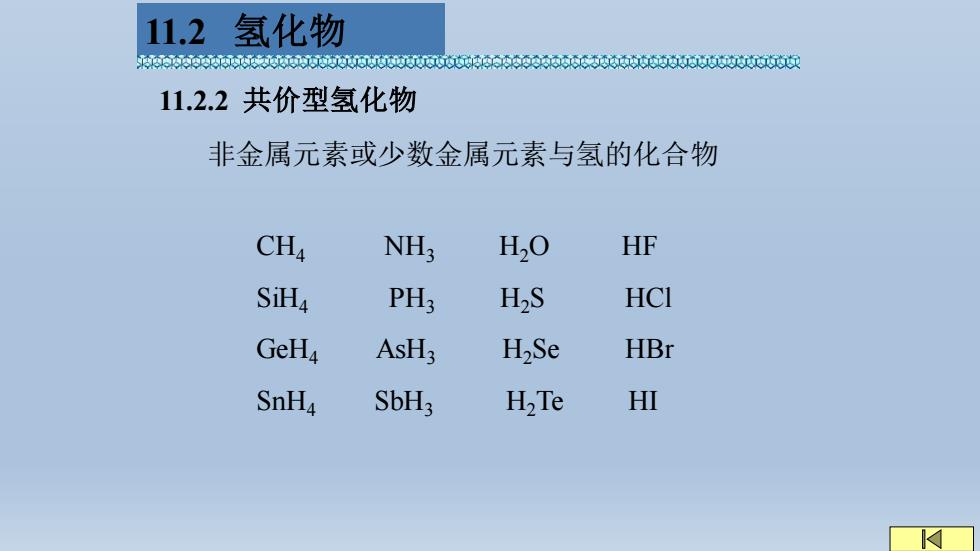
11.2氢化物 e060660000000060606006t6660Q 11.2.2共价型氢化物 非金属元素或少数金属元素与氢的化合物 CHa NH3 H20 HF SiHa PH; H2S HCI GeHa AsH3 H2Se HBr SnH4 SbH3 H2Te HI
11.2.2 共价型氢化物 非金属元素或少数金属元素与氢的化合物 CH4 NH3 H2O HF SiH4 PH3 H2S HCl GeH4 AsH3 H2Se HBr SnH4 SbH3 H2Te HI 11.2 氢化物