
第九章 化学键和分子结构(8) ○9.1离子键及离子化合物 9.2价键理论及共价化合物 9.3分子间力和氢键 9.4晶体结构简介(自学) 9.5超分子化学(自学) 本章作业
第九章 化学键和分子结构(8h) 9.1 离子键及离子化合物 9.2 价键理论及共价化合物 9.3 分子间力和氢键 9.4 晶体结构简介(自学) 9.5 超分子化学(自学) 本章作业

9.1离子键及离子化合物
9.1 离子键及离子化合物

9.1.1离子键(自学) 内容提纲: 1.离子键的形成 2.离子键的主要特征(无方向性、无饱和性) 3.决定离子化合物性质的因素 (1)离子半径及其变化规律 (2)离子的电荷 (3)离子的电子构型 4.品格能
9.1.1 离子键(自学) 内容提纲: 1. 离子键的形成 2. 离子键的主要特征(无方向性、无饱和性) 3. 决定离子化合物性质的因素 (1)离子半径及其变化规律 (2)离子的电荷 (3)离子的电子构型 4. 晶格能
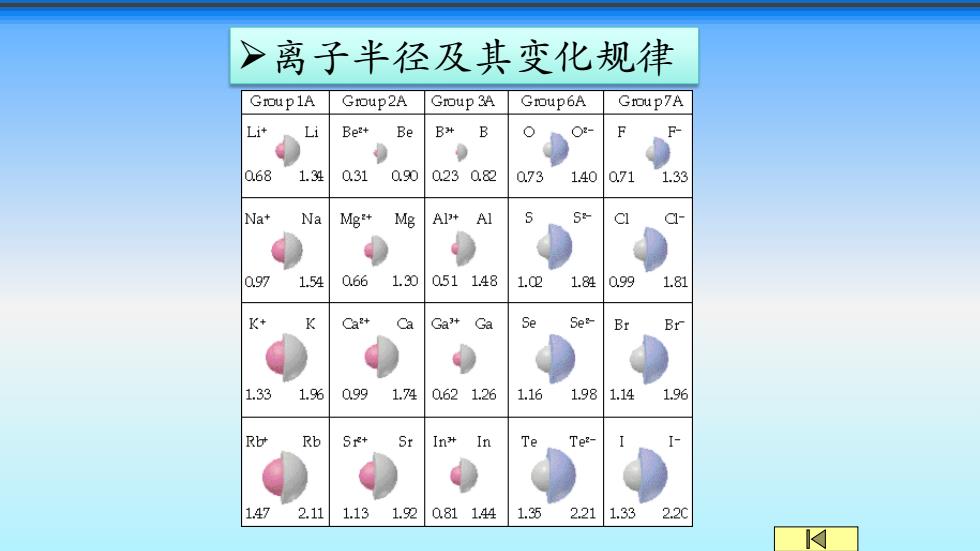
>离子半径及其变化规律 Group1A Group2A Group 3A Gmoup6A Group7A L计 Li Be+ Be B>B 0.68 1.34 0.31 090 0230.82 073 1.40 0.71 1.33 Na+ Na Mg+ Mg Ap+Al 0.97 1.54 0.661.30 0511.48 1.021.84 099 1.81 K+ Ca+ Ca Ga+ Ga Se 5e& Br Br 1.33 1.6 0991.74 0621.26 1.161.981.141.96 Rb Rb Sr+ Sr In* In Te- 1.47 2.11 1.131.920811.441.35 2.211.332.2
➢离子半径及其变化规律

>离子的电子构型 ※正离子的电子构型: ·2电子构型:(n-1)s2 如:Lit、Be2+ 8电子构型:n-1)s2n-1)p6 如:K+、Na+、Al3+ 18电子构型:n-1)s2(n-1)p(n-1)d10 如:Ag*、Hg2+ 18+2电子构型:n-1)s2(n-1)p6(n-1)d10ns2如:Sn2+、Pb2+ 9~17电子构型:n-1)s2(n-1)p6(n-1)d19 如:Fe2+、Mn2+ ※负离子的电子构型: 均为8电子构型
➢ 离子的电子构型 ※ 正离子的电子构型: • 2电子构型:(n-1)s2 如:Li+ 、Be2+ • 8电子构型:(n-1)s2 (n-1)p6 如: K+、Na+ 、Al3+ •18电子构型:(n-1)s2 (n-1)p6 (n-1)d10 如:Ag+ 、Hg2+ •18 + 2电子构型:(n-1)s2 (n-1)p6 (n-1)d10ns 2 如:Sn2+ 、Pb2+ •9 ~ 17电子构型:(n-1)s2 (n-1)p6 (n-1)d1~9 如:Fe2+ 、Mn2+ ※ 负离子的电子构型: 均为8电子构型