
11.1单质 e63000606600t6达60065066665td056t600达收 11.1.2单质的化学性质 1.单质的氧化还原性 s区元素一单质均为活泼金属,具有很强的还原性易形成阳 离子盐 p区元素一绝大多数非金属元素即具有氧化性,又具有还原性 与金属作用时表现出氧化性,形成负氧化值,如:氧化物、 硫化物、氮化物、碳化物、卤化物、硅化物、硼化物、含氧 酸盐(如:NaBiO3)等 与活泼非金属反应时表现出还原性,形成正氧化值,如:氧化 物、卤化物、氢化物、含氧酸等 ☒
11.1.2 单质的化学性质 1. 单质的氧化还原性 s区元素——单质均为活泼金属,具有很强的还原性易形成阳 离子盐 p区元素——绝大多数非金属元素即具有氧化性,又具有还原性 •与金属作用时表现出氧化性,形成负氧化值,如:氧化物、 硫化物、氮化物、碳化物、卤化物、硅化物、硼化物、含氧 酸盐(如:NaBiO3 )等 •与活泼非金属反应时表现出还原性,形成正氧化值,如:氧化 物、卤化物、氢化物、含氧酸等 11.1 单质

11.1单质 e00606600英0t0英近00000666000660600000006005Q 2.与水的反应性 ·金属单质与水的作用:s区元素与水作用 2M+2HO→2MOH+H2↑ IA族元素) M+2H20→M(OH2+H2↑ (ⅡA族元素) Li Na K Ca
2.与水的反应性 • 金属单质与水的作用:s区元素与水作用 2M + 2H2O → 2MOH + H2↑ (IA族元素) Li Na K Ca M + 2H2O → M(OH)2+ H2↑ (IIA族元素) 11.1 单质

11.1单质 6t55065050600英0050女66免6660t066达英英66 ·卤素与水的作用 F2、Cl2、B2与水的作用 2X2+2H20=4HX+O2↑(氧化水的作用) C2、Br2、I2在水中的歧化反应 X,+H,O=H+X+HXO(可逆反应,碱性严重) 注:除卤素外大部分非金属元素不与水反应
• 卤素与水的作用 F2、Cl2、Br2与水的作用 2X2+2H2O=4HX+O2↑(氧化水的作用) Cl2、Br2、I2在水中的歧化反应 X2+H2O =H++X-+HXO (可逆反应,碱性严重) 注:除卤素外大部分非金属元素不与水反应 11.1 单质

11.1单质 666000066560005600600灰055t066600660060t060560000心00坎 3.与酸的反应性 ·大部分金属元素可以与酸反应,置换出氢气 如:2A1+6HC1=2A1CI3+3H2↑ ·非金属一般不和稀酸反应,L2、S、P、C、B可与浓HNO3或热 的浓HSO4反应,反应方程式如下: S+2HNO3=H,SO4+2NO↑ 3P4+8H2O+20HNO312HP04+20N0↑ 3C+4HNO3=3C02↑+4N0↑+2H20 3I2+10HNO,=6HIO+10NO1+2H2O B+3HNO;=B(OH)3 +3NO21 2B+3H2S0,(热浓)=2B(0H)3+3S021
3. 与酸的反应性 • 大部分金属元素可以与酸反应,置换出氢气 如:2Al+6HCl=2AlCl3+3H2↑ • 非金属一般不和稀酸反应,I2、S、P、C、B可与浓HNO3或热 的浓H2SO4反应,反应方程式如下: S+2HNO3=H2SO4+2NO↑ 3P4+8H2O+20HNO3=12H3PO4+20NO↑ 3C+4HNO3=3CO2↑ +4NO↑ +2H2O 3I2+10HNO3=6HIO3+10NO↑+2H2O B+3HNO3=B(OH)3 +3NO2 ↑ 2B+3H2SO4 (热浓)=2B(OH)3 +3SO2↑ 11.1 单质
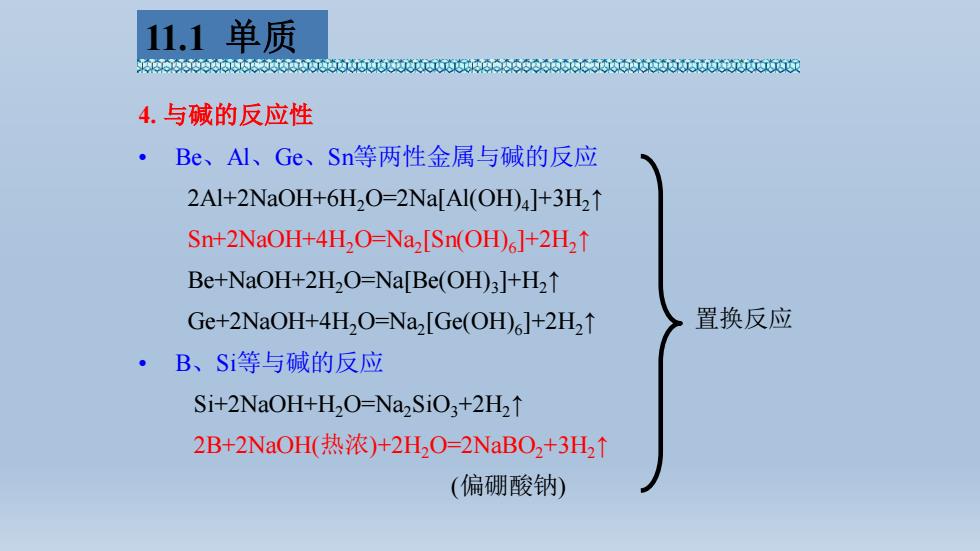
11.1单质 6p63006000000t6达06006500656655t6655560060女 4.与碱的反应性 。 Be、Al、Ge、Sn等两性金属与碱的反应 2Al+2NaOH+6H2O=2Na[Al(OD)4]+3H2t↑ Sn+2NaOH+4H2O=Na,[Sn(OH)]+2H21 Be+NaOH+2H2O=Na[Be(OH)3]+H21 Ge+2NaOH+4H,O=Na,[Ge(OH)]+2H21 置换反应 ·B、Si等与碱的反应 Si+2NaOH+H2O=Na2SiO,+2H21 2B+2NaOH(热浓)+2HO-2NaBO2+3H2↑ (偏硼酸钠)
4. 与碱的反应性 • Be、Al、Ge、Sn等两性金属与碱的反应 2Al+2NaOH+6H2O=2Na[Al(OH)4 ]+3H2↑ Sn+2NaOH+4H2O=Na2 [Sn(OH)6 ]+2H2↑ Be+NaOH+2H2O=Na[Be(OH)3 ]+H2↑ Ge+2NaOH+4H2O=Na2 [Ge(OH)6 ]+2H2↑ • B、Si等与碱的反应 Si+2NaOH+H2O=Na2SiO3+2H2↑ 2B+2NaOH(热浓)+2H2O=2NaBO2+3H2↑ (偏硼酸钠) 置换反应 11.1 单质