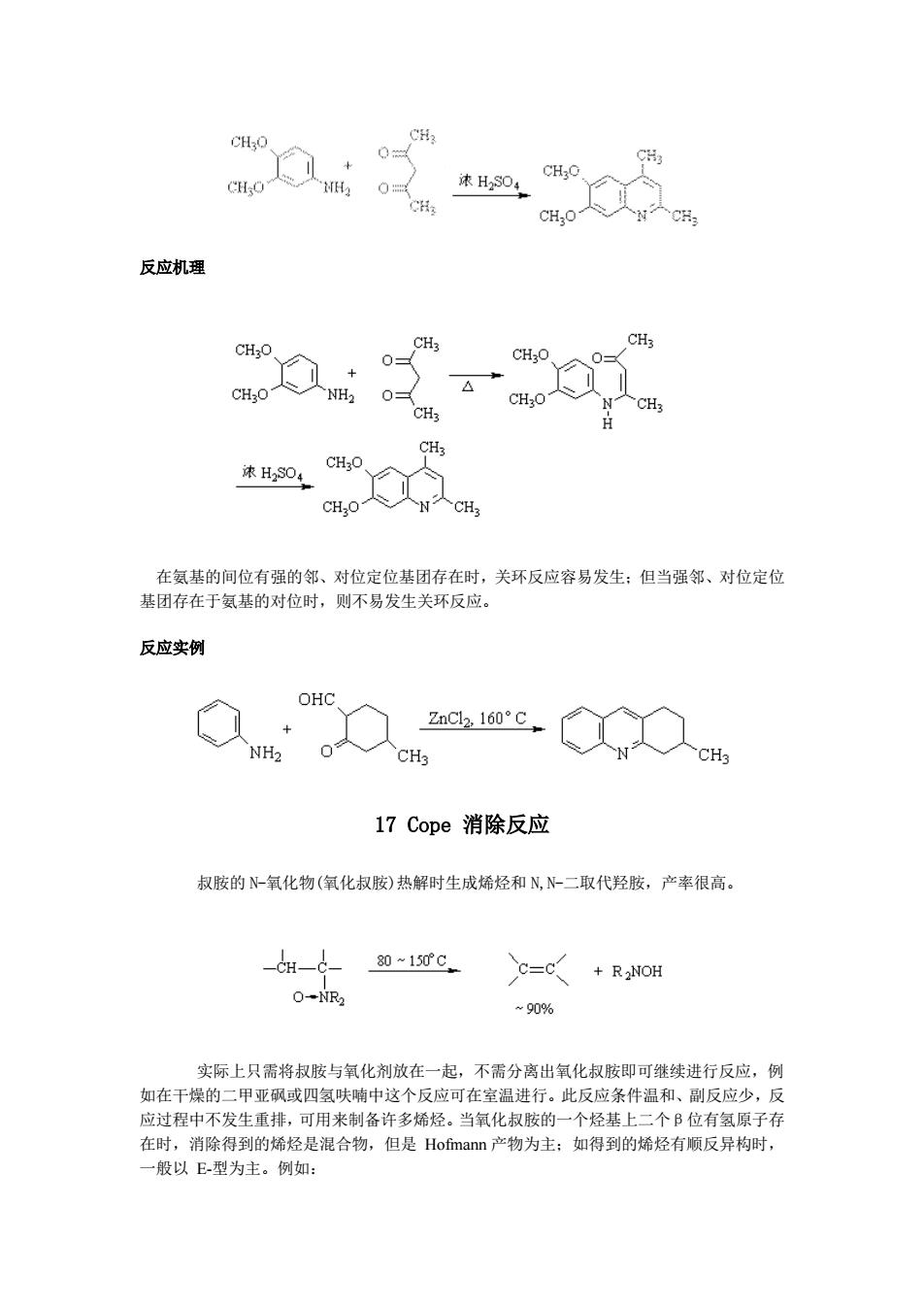
CHO CHa 0 速H304 CHO CHO C CHO 反应机理 CH3O CH3 CHs 0- CHO CH3O NH2 4 0三 CH3O CH3 CH3 H CH3 CHO 浓H2S04 CHO CH3 在氨基的间位有强的邻、对位定位基团存在时,关环反应容易发生:但当强邻、对位定位 基团存在于氨基的对位时,则不易发生关环反应。 反应实例 OHC ZnC2,160°C + NH2 0 CH3 CH3 17Cope消除反应 叔胺的N-氧化物(氧化叔胺)热解时生成烯烃和N,N-二取代羟胺,产率很高。 80~150C C=C +R2NOH O-NR2 ~90% 实际上只需将叔胺与氧化剂放在一起,不需分离出氧化叔胺即可继续进行反应,例 如在干燥的二甲亚砜或四氢呋喃中这个反应可在室温进行。此反应条件温和、副反应少,反 应过程中不发生重排,可用来制备许多烯烃。当氧化叔胺的一个烃基上二个B位有氢原子存 在时,消除得到的烯烃是混合物,但是Hofmann产物为主:如得到的烯烃有顺反异构时, 一般以E型为主。例如:
反应机理 在氨基的间位有强的邻、对位定位基团存在时,关环反应容易发生;但当强邻、对位定位 基团存在于氨基的对位时,则不易发生关环反应。 反应实例 17 Cope 消除反应 叔胺的 N-氧化物(氧化叔胺)热解时生成烯烃和 N,N-二取代羟胺,产率很高。 实际上只需将叔胺与氧化剂放在一起,不需分离出氧化叔胺即可继续进行反应,例 如在干燥的二甲亚砜或四氢呋喃中这个反应可在室温进行。此反应条件温和、副反应少,反 应过程中不发生重排,可用来制备许多烯烃。当氧化叔胺的一个烃基上二个β位有氢原子存 在时,消除得到的烯烃是混合物,但是 Hofmann 产物为主;如得到的烯烃有顺反异构时, 一般以 E-型为主。例如:
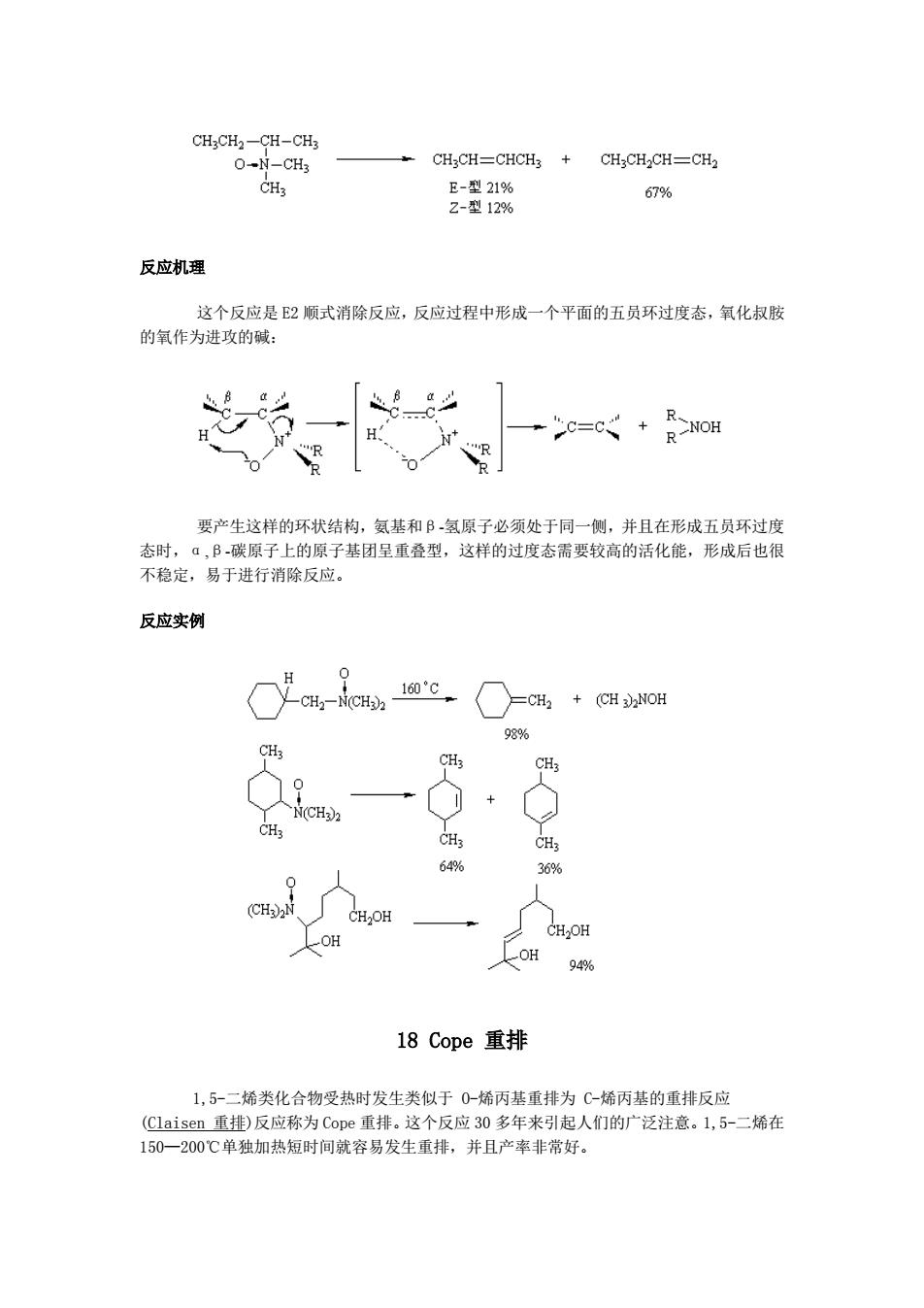
CH3CH2-CH-CH3 O-N-CH3 CH2CH=CHCH3 CH3CH2CH-CH2 CH3 E-型21% 67% Z-型12% 反应机理 这个反应是2顺式消除反应,反应过程中形成一个平面的五员环过度态,氧化叔胺 的氧作为进攻的碱: C=C R-NOH 要产生这样的环状结构,氨基和B-氢原子必须处于同一侧,并且在形成五员环过度 态时,α,B-碳原子上的原子基团呈重叠型,这样的过度态需要较高的活化能,形成后也很 不稳定,易于进行消除反应。 反应实例 0 160°C CH2-N(CH)2 =CH2 (CH 3NOH 98% CH3 CH3 + N(CH2 CH3 CH3 CH3 64% 36% 0 (CH)2N CH2OH CH2OH OH OH 94% 18Cope重排 1,5-二烯类化合物受热时发生类似于0-烯丙基重排为C-烯丙基的重排反应 (Claisen重排)反应称为Cope重排。这个反应30多年来引起人们的广泛注意。1,5-二烯在 150一200℃单独加热短时间就容易发生重排,并且产率非常好
反应机理 这个反应是 E2 顺式消除反应,反应过程中形成一个平面的五员环过度态,氧化叔胺 的氧作为进攻的碱: 要产生这样的环状结构,氨基和β-氢原子必须处于同一侧,并且在形成五员环过度 态时,α,β-碳原子上的原子基团呈重叠型,这样的过度态需要较高的活化能,形成后也很 不稳定,易于进行消除反应。 反应实例 18 Cope 重排 1,5-二烯类化合物受热时发生类似于 O-烯丙基重排为 C-烯丙基的重排反应 (Claisen 重排)反应称为 Cope 重排。这个反应 30 多年来引起人们的广泛注意。1,5-二烯在 150—200℃单独加热短时间就容易发生重排,并且产率非常好
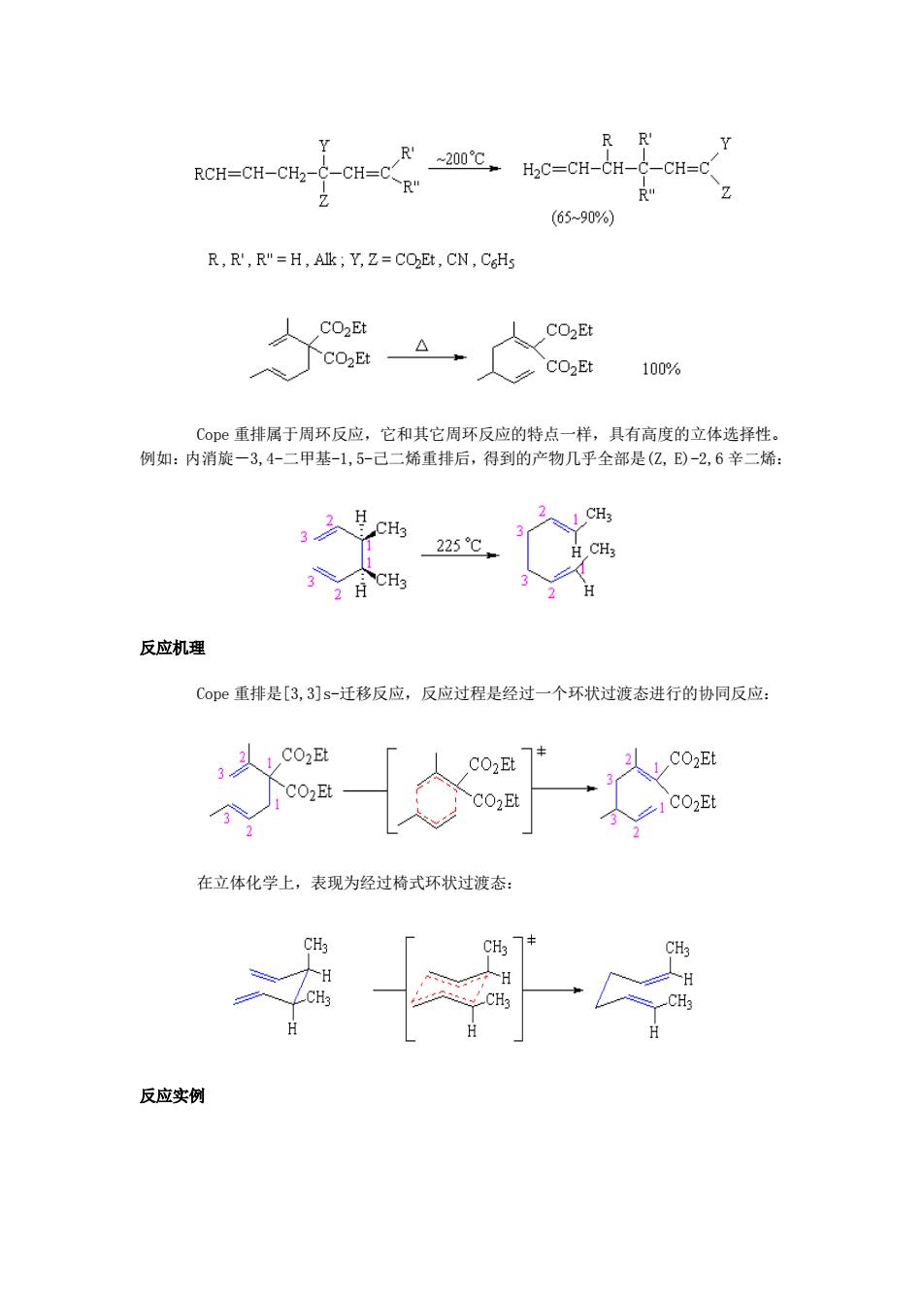
RCH-CH-CHa--CH-CR -200℃ H2C=CH-CH-C-CH=C R" (65-90%) R,R',R"=H,AIk Y,Z=COEt,CN,C6Hs CO2Et CO2Et CO2Et CO2Et 100% Coe重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。 例如:内消旋一3,4-二甲基-1,5-己二烯重排后,得到的产物几乎全部是(亿,E)-2,6辛二烯: H CH3 3 CH3 225℃ CHz CH3 H H 反应机理 Cope重排是[3,3]s-迁移反应,反应过程是经过一个环状过渡态进行的协同反应: CO2Et CO2Et CO2Et CO2Et 在立体化学上,表现为经过椅式环状过渡态: H H CH3 反应实例
Cope 重排属于周环反应,它和其它周环反应的特点一样,具有高度的立体选择性。 例如:内消旋-3,4-二甲基-1,5-己二烯重排后,得到的产物几乎全部是(Z, E)-2,6 辛二烯: 反应机理 Cope 重排是[3,3]s-迁移反应,反应过程是经过一个环状过渡态进行的协同反应: 在立体化学上,表现为经过椅式环状过渡态: 反应实例
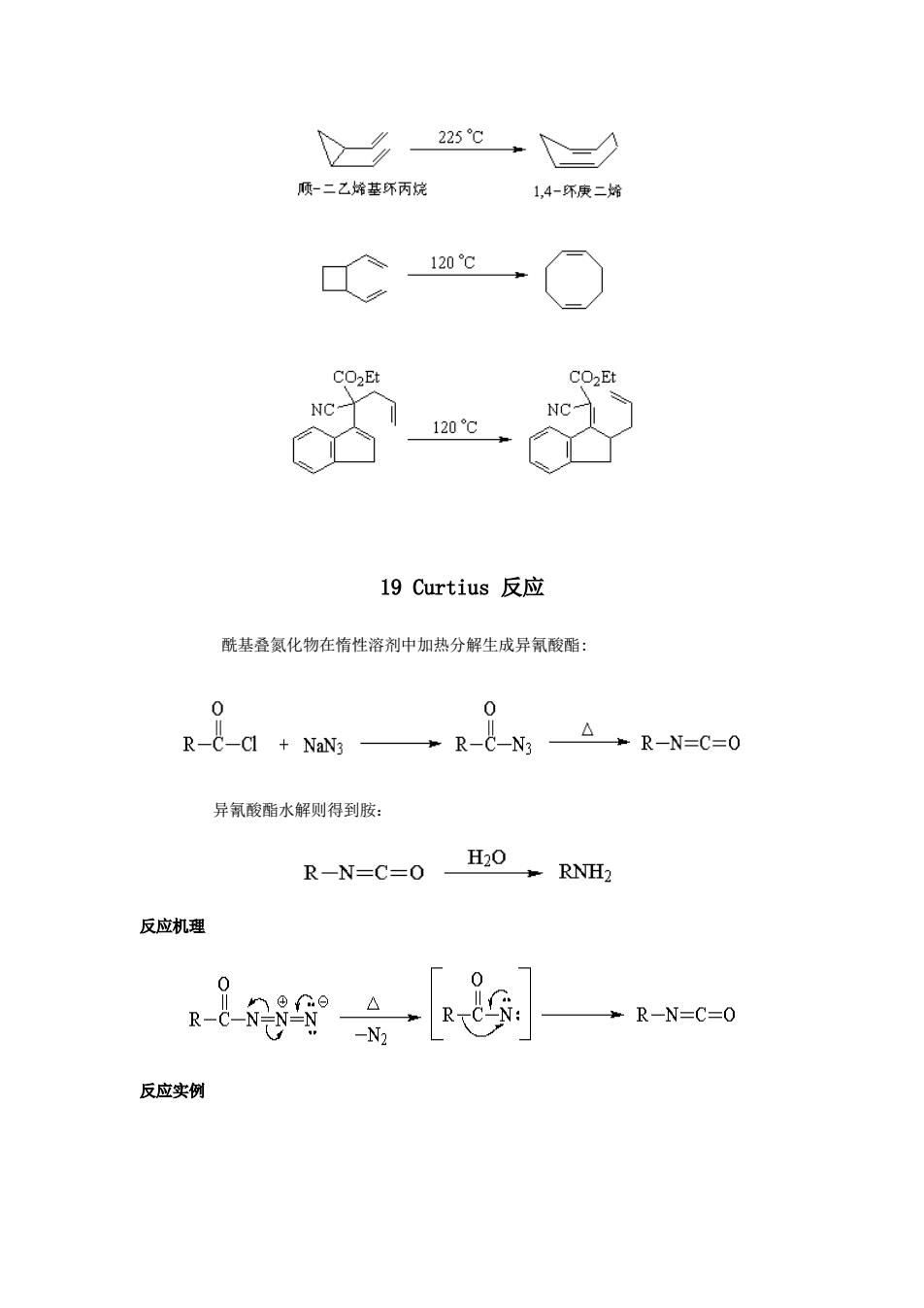
225℃→ 顺-二乙烯基环丙烷 1,4-环庚二烯 120℃ CO2Et CO2Et NC- NC- 120℃ 19 Curtius反应 酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯: 0 0 R-C-Cl NaN3 R-C-N3 R-N=C=0 异氰酸酯水解则得到胺: R-N=C=0 H20* RNH2 反应机理 0 0 R-N=C=0 反应实例
19 Curtius 反应 酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯: 异氰酸酯水解则得到胺: 反应机理 反应实例
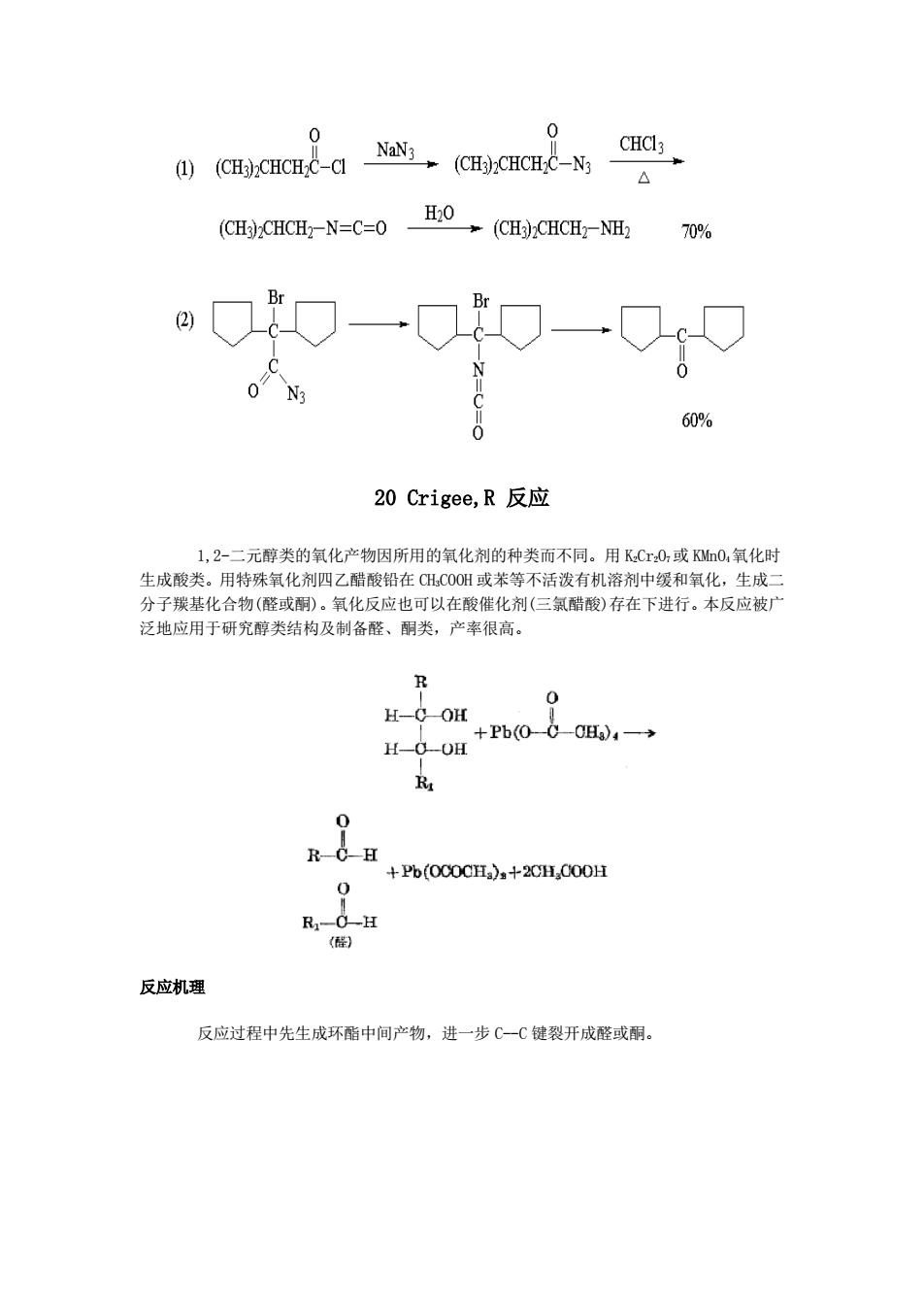
0 CH-CHCHC-CI NaN3 (CH)CHCHC-N3 CHCI3 1) H20 (CH?CHCH2-N=C=0 (CH3)CHCH2-NH2 70% Br 2 60% 20 Crigee,R反应 1,2-二元醇类的氧化产物因所用的氧化剂的种类而不同。用KCr0,或KM0,氧化时 生成酸类。用特殊氧化剂四乙醋酸铅在CHC0OH或苯等不活泼有机溶剂中缓和氧化,生成二 分子羰基化合物(醛或酮)。氧化反应也可以在酸催化剂(三氯醋酸)存在下进行。本反应被广 泛地应用于研究醇类结构及制备醛、酮类,产率很高。 R 0 H-C OH +Pb(00-Cg)4一 H-0-OH 0 Pb(OCOCH)+2CHCOOH 0 R1-O一H (醛) 反应机理 反应过程中先生成环酯中间产物,进一步C一C键裂开成醛或酮
20 Crigee,R 反应 1,2-二元醇类的氧化产物因所用的氧化剂的种类而不同。用 K2Cr2O7或 KMnO4氧化时 生成酸类。用特殊氧化剂四乙醋酸铅在 CH3COOH 或苯等不活泼有机溶剂中缓和氧化,生成二 分子羰基化合物(醛或酮)。氧化反应也可以在酸催化剂(三氯醋酸)存在下进行。本反应被广 泛地应用于研究醇类结构及制备醛、酮类,产率很高。 反应机理 反应过程中先生成环酯中间产物,进一步 C--C 键裂开成醛或酮