
有机反应规则总结 1 Arbuzov 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代 烷: R RO)3P R'X →RO2P=O+RX 亚磷酸三烷基酯 烷基群酸二烷基 卤代烷反应时,其活性次序为:R'I>R'B肛>RC1。除了卤代烷外,烯丙型或炔丙型 卤化物、-卤代醚、a-或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基 酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应 制得: 3ROH+PC13·(RO)3P 如果反应所用的卤代烷R'X的烷基和亚磷酸三烷基酯(RO)P的烷基相同(即R'=R), 则Arbuzov反应如下: RO)3P RX R-P(OR) X=Br,CI,I 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯RP(OR')2和次亚膦酸酯RPOR'也能发生该类反 应,例如: R-P(OR)R"X OR' +R'X R R-P-OR' R'X
有机反应规则总结 1 Arbuzov 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代 烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型 卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚磷酸三烷基 酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应 制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R), 则 Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2 和次亚膦酸酯 R2POR' 也能发生该类反 应,例如:
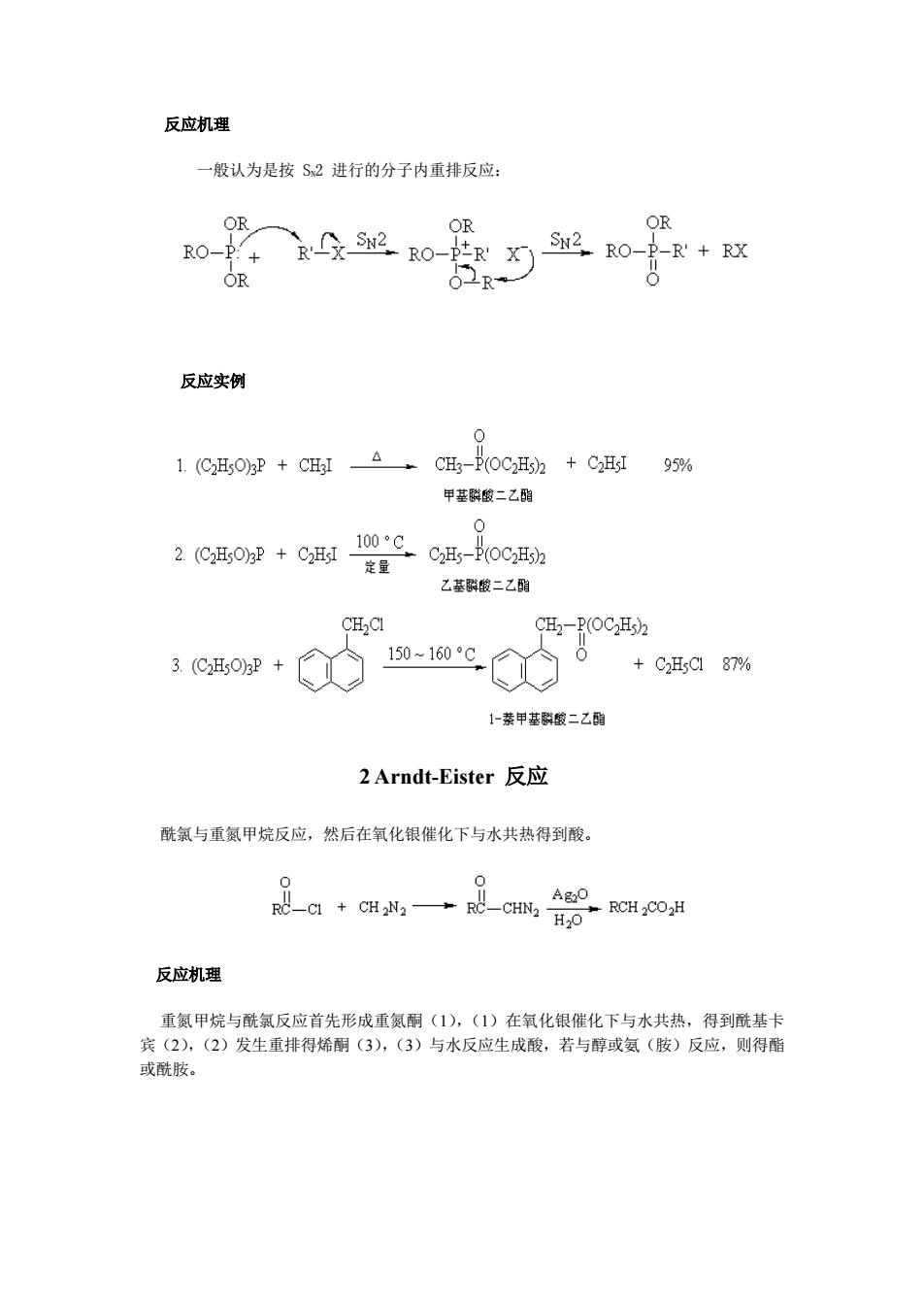
反应机理 般认为是按S2进行的分子内重排反应: OR OR OR RO- SN2, RO- P-R'+RX OR 反应实例 1.(C2HsO)3P CH3I CH3-P(OC2Hs)+C2HsI 95% 甲基群酸二乙硝 100°C 2.(C2HsO)3P C2HsI 定量 C2Hs-P(OC2Hs) 乙基群酸二乙酯 CH2CI CH2-P(OC2Hs) 3.(C2H5O)2P 150~160°C +C2H5C187% 1-萘甲基磔酸二乙酯 2 Arndt-Eister反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 -C1+CH2N2+ RC- A20 -CHN2 RCH2COH H20 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡 宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯 或酰胺
反应机理 一般认为是按 SN2 进行的分子内重排反应: 反应实例 2 Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡 宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯 或酰胺
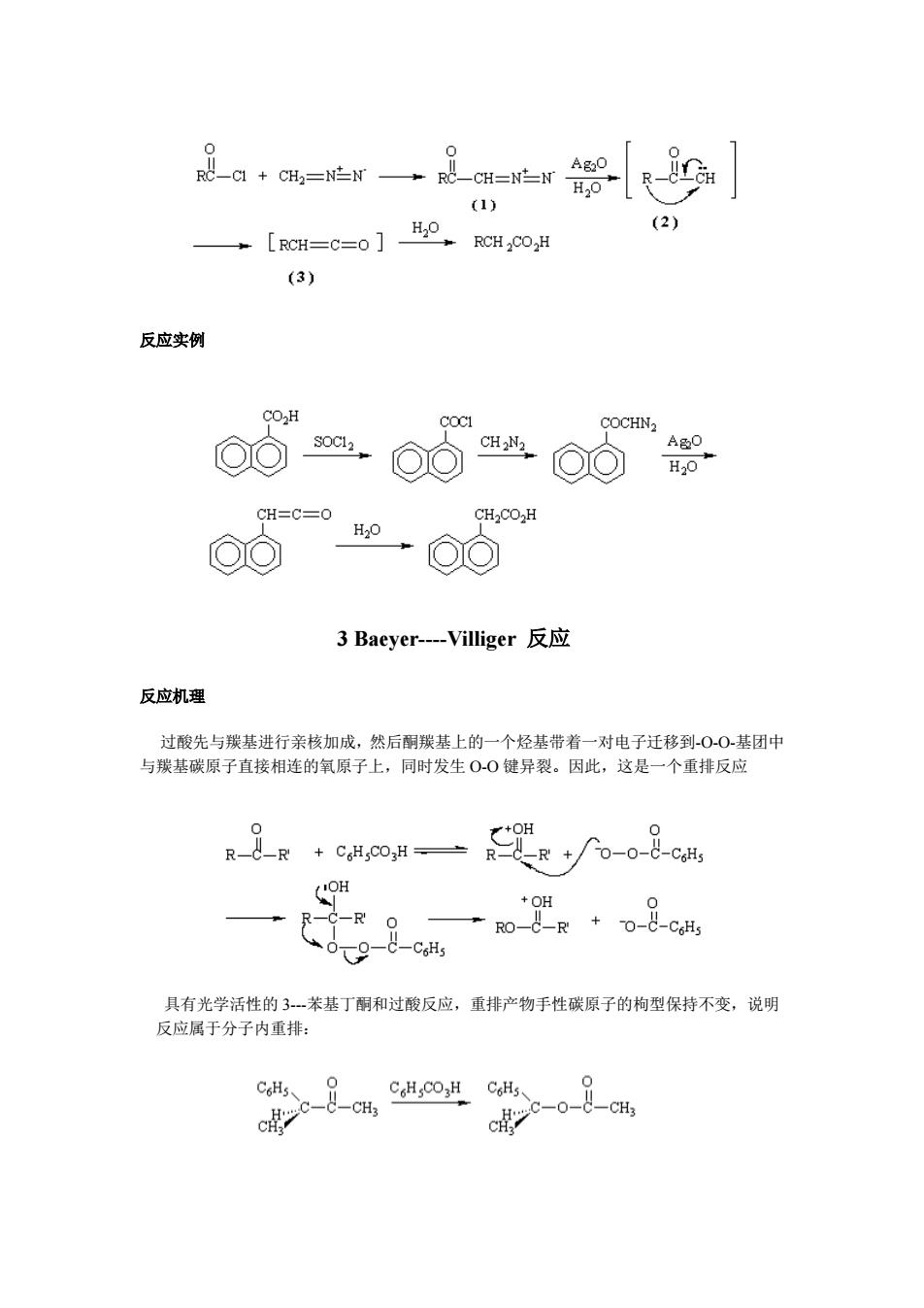
AgO H20 (1) H20 (2) LRCH=C=o RCHCO H (3) 反应实例 CO.H COCHN2 AgO O H20 CH=C=0 CH2CO2H H20 3 Baeyer---Villiger反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-0-基团中 与羰基碳原子直接相连的氧原子上,同时发生O-0键异裂。因此,这是一个重排反应 0 R-d-R OH po-cu +OH _C-CoHs 具有光学活性的3--苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明 反应属于分子内重排: C6H5、 C。H,Co,HC6H5、 0 cc-o-8-CH
反应实例 3 Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中 与羰基碳原子直接相连的氧原子上,同时发生 O-O 键异裂。因此,这是一个重排反应 具有光学活性的 3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明 反应属于分子内重排:
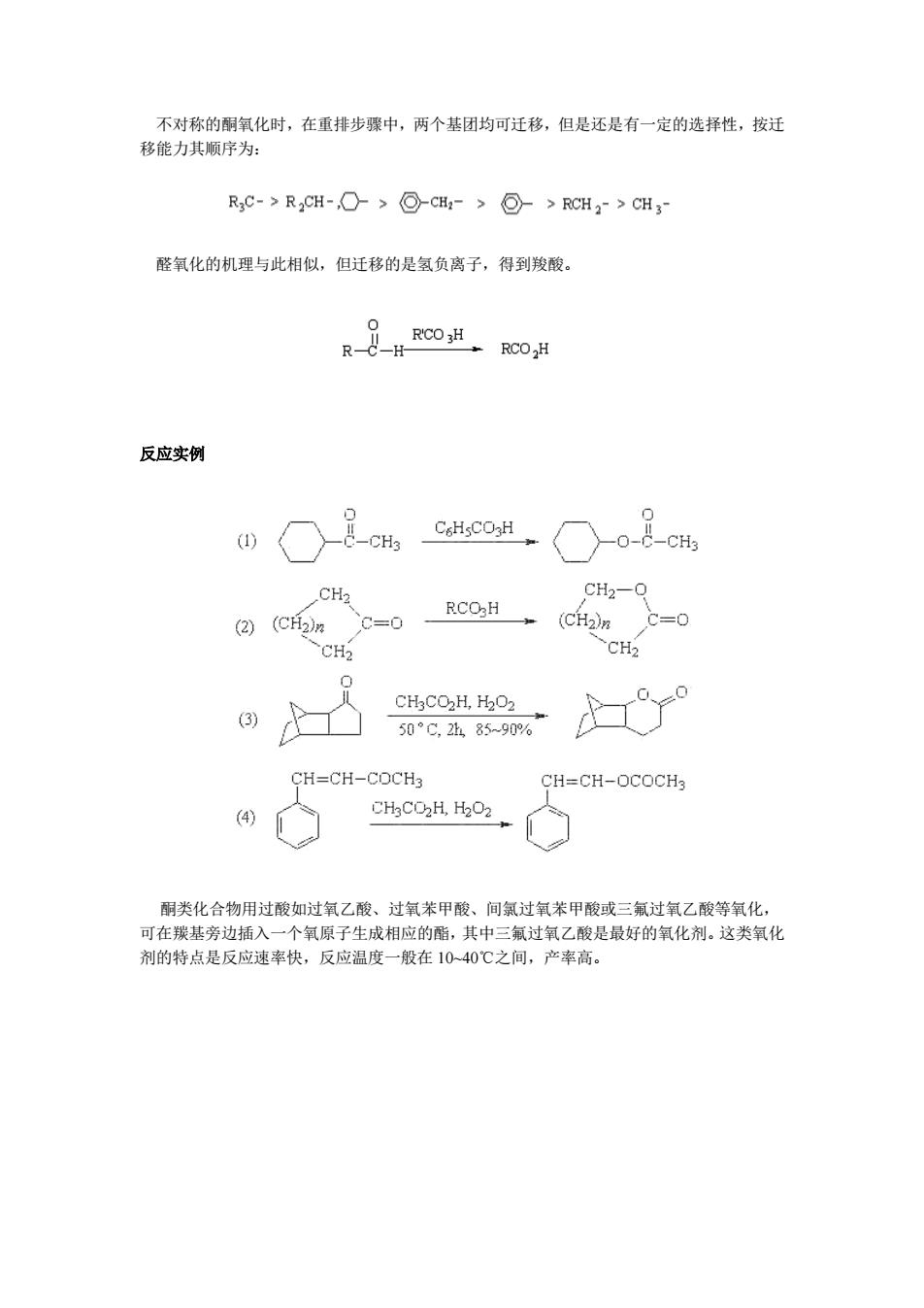
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁 移能力其顺序为: RC->R2CH->-CH:->>RCH2->CH3- 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 R'CO 3H R-C -H- RCOH 反应实例 CsHsCO3H (1) CH3 -CH3 CH2 CH2-O RCOH (2) (CH2)n C=0 (CH2)n C= CH2 ~CH2 CH3CO2H,H2O2 (3) 50°C,28590% CH=CH-COCH3 CH=CH-OCOCH3 (4) CHgCO2H,H2O2 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化, 可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化 剂的特点是反应速率快,反应温度一般在10~40℃之间,产率高
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁 移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化, 可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化 剂的特点是反应速率快,反应温度一般在 10~40℃之间,产率高
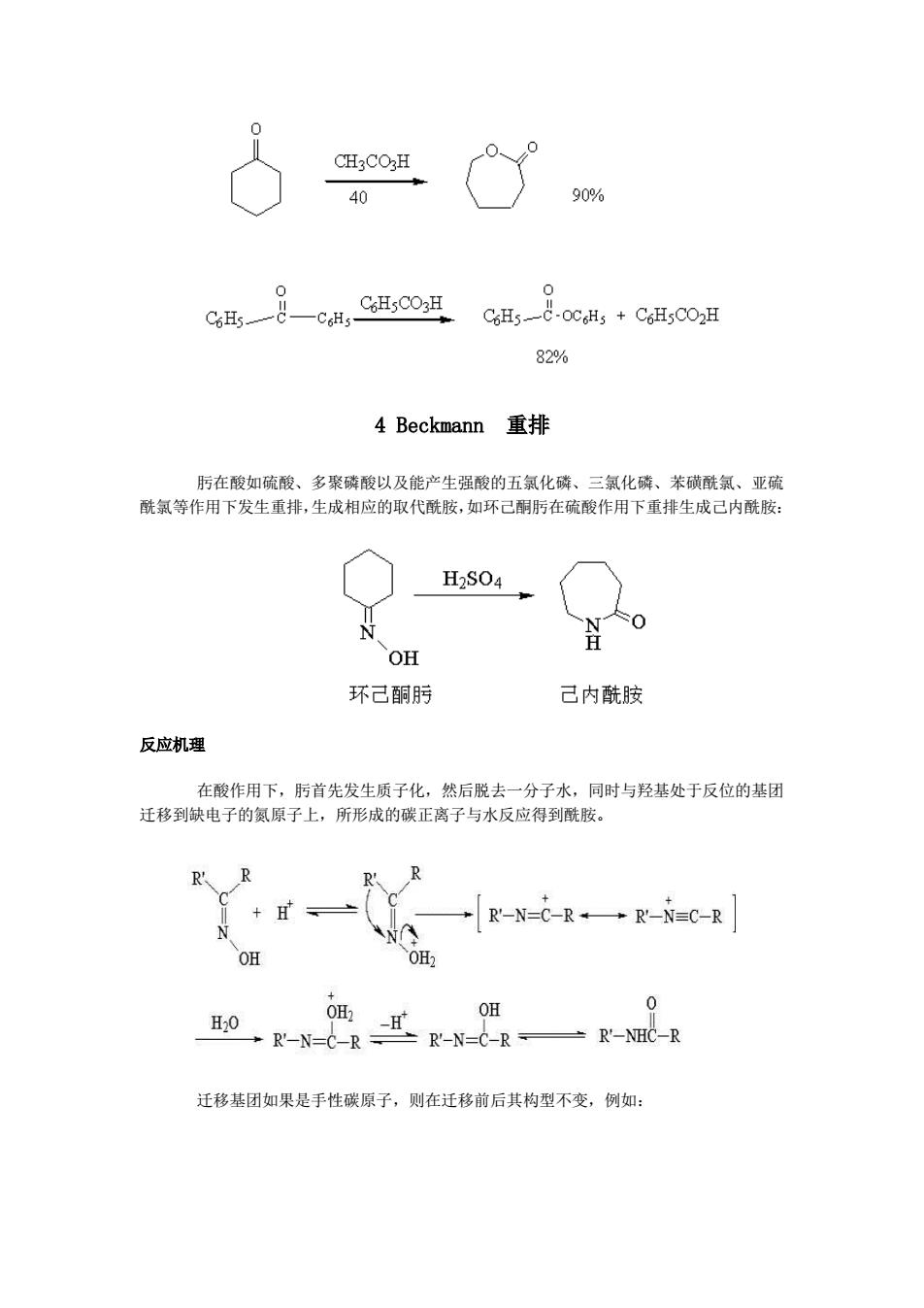
0 CHCOH 40 90% 0 0 CHsCOH C6H5-&-0cH;+C6H5C02H 82% 4 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫 酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: H2S04 OH 环己酮肟 己内酰胺 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团 迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 R' R-N=C-R→R-N=C-R OH OH 0 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:
4 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫 酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团 迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。 迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如: